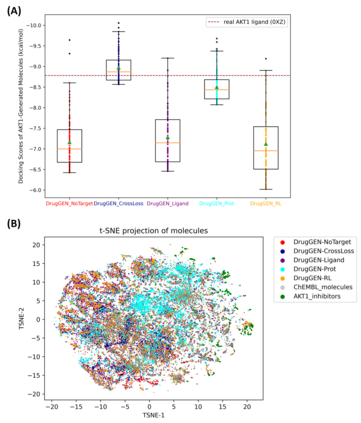
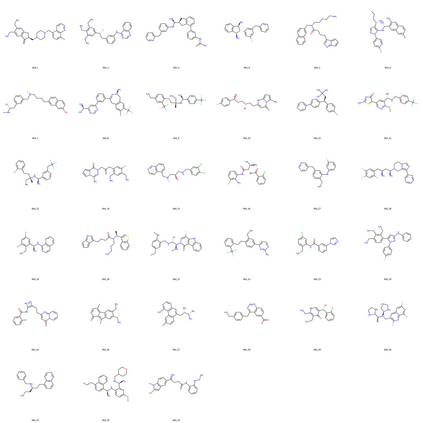
Discovering novel drug candidate molecules is one of the most fundamental and critical steps in drug development. Generative deep learning models, which create synthetic data given a probability distribution, have been developed with the purpose of picking completely new samples from a partially known space. Generative models offer high potential for designing de novo molecules; however, in order for them to be useful in real-life drug development pipelines, these models should be able to design target-specific molecules, which is the next step in this field. In this study, we propose DrugGEN, for the de novo design of drug candidate molecules that interact with selected target proteins. The proposed system represents compounds and protein structures as graphs and processes them via serially connected two generative adversarial networks comprising graph transformers. DrugGEN is trained using a large dataset of compounds from ChEMBL and target-specific bioactive molecules, to design effective and specific inhibitory molecules against the AKT1 protein, which has critical importance for developing treatments against various types of cancer. On fundamental benchmarks, DrugGEN models have either competitive or better performance against other methods. To assess the target-specific generation performance, we conducted further in silico analysis with molecular docking and deep learning-based bioactivity prediction. Results indicate that de novo molecules have high potential for interacting with the AKT1 protein structure in the level of its native ligand. DrugGEN can be used to design completely novel and effective target-specific drug candidate molecules for any druggable protein, given target features and a dataset of experimental bioactivities. Code base, datasets, results and trained models of DrugGEN are available at https://github.com/HUBioDataLab/DrugGEN
翻译:发现新的药物候选分子是药物开发的最根本和关键步骤之一。开发了创造合成数据概率分布的基因深层次学习模型,目的是从部分已知的空间采集全新的全新样本。生成模型为设计新分子提供了巨大的潜力;但是,为了使这些模型能够用于现实生活中的药物开发管道,这些模型应当能够设计针对特定目标的分子,这是这一领域的下一个步骤。在本研究中,我们建议药物GEN,用于与选定目标蛋白进行互动的药物候选分子的无意识设计。拟议的系统代表化合物和蛋白质结构,作为图表,并通过由图形变异器组成的两个连成的基因对抗性对立网络进行处理。 药物GENGEN用大量来自CEEMBL的化合物和特定生物活性分子的化合物数据集来设计有效的和特定的抑制性分子分子分子分子,而AKT1蛋白对于发展各种癌症的治疗至关重要。 在基本基准中,药物候选蛋白质蛋白质分子的模型具有竞争性或更好的性能 与其他方法相比。为了评估目标-具体性、分子的分子-分子-分子-分子-血液-血液-血液-血液-血液-血液-血液-血液-血液-血液-血液-血液-血液-血液-血液-血液-血液-血液-血液-血液-血液-血液-血液-血液-血液-分析,我们在-血液-血液-血液-血液-血液-血液-血液-血液-血液-血液-生物-血液-血液-血液-血液-血液-生物-生物-血液-血液-血液-血液-血液-血液-血液-血液-血液-数据学学学能学学学学学学学学学学学学学学学学学学学学数据,我们进行数据分析,我们用数据分析,我们用数据分析,我们用数据分析,我们用数据分析,我们用数据分析,我们进行有效的数据分析,我们进行数据分析,我们用数据分析。