双次造血干细胞移植
【Blood】如何治疗年轻多发性骨髓瘤患者
多发性骨髓瘤(MM)表现为骨髓中恶性浆细胞克隆性增殖,血尿单克隆蛋白增多,导致相关器官功能障碍。MM中位诊断年龄70岁,37%患者诊断时年龄<65岁。过去15年里,MM治疗进展飞速,虽仍不可治愈,但总生存(OS)明显改善,因此有必要优化年轻患者的治疗策略,减少治疗毒性对生活质量的影响。美国Gandolfi教授在BLOOD杂志发文,就上述问题进行了阐述(年轻患者定义为<65岁,为适合移植年龄)。
何时开始治疗:新的诊断标准
活动性MM的诊断为临床病理标准,即需有浆细胞疾病导致器官功能受损的证据。随着新药治疗耐受性的改善,明确易进展为活动性疾病的冒烟型MM(SMM)并提早治疗很有必要。因此,国际骨髓瘤工作组(IMWG)对MM定义进行了修订,以便在发生器官损害前早期诊断及治疗。特异性标志和影像学技术的进展促进了诊断标准的更新(表1),可精确区分2年内≥80%机会进展的SMM,从而早期干预。
MM诊断需要CRAB表现(表1)和3个特异性标志,特异性标志包括骨髓克隆性浆细胞≥60%、血游离轻链(FLC)比值≥100(受累FLC≥100mg/L)、MRI可见>1处损害(≥5mm )。每种标志均提示有80%风险进展为有症状器官损害。虽然IMWG修订了MM标准,但临床实践中SMM仍有争议,亦无明确分子标志鉴别高进展风险的患者,因此需要更多研究。
作者观点
根据2014 IMWG标准对活动性MM进行治疗;对于年轻SMM患者而言,如有合适临床研究,可加入研究进行早期干预,并将其作为总体治疗策略的一部分,同时密切观察,采用双磷酸盐治疗减少骨丢失。
表1 多发性骨髓瘤和相关疾病的诊断标准
风险分层
分子生物学和遗传学进展促进了对MM进展病因的理解,主要是克隆内异质性影响疾病进展和治疗耐药,此外克隆性浆细胞与骨髓微环境的相互作用也有较大影响。
因疾病异质性,MM风险分层很具挑战。研究证实,多个生物学因素可影响MM风险和预后。D-S分期系统根据临床参数预测肿瘤负荷;ISS则通过β2微球蛋白和白蛋白明确肿瘤负荷和疾病对宿主的影响;IMWG近期采纳R-ISS对新诊断MM (NDMM)进行分层(表2),分层因素包括ISS、细胞遗传学和乳酸脱氢酶(LDH)。一项纳入4445例NDMM的研究显示,R-ISS I、II和III期患者5年生存率分别为82%、62%和40%。R-ISS分期患者多采用新的治疗方法,与ISS分期患者相比,OS改善。
表2 R-ISS分期标准
然而,R-ISS分期的相关研究具有局限性:研究中只纳入年轻患者的选择偏倚、异常染色体未全部纳入、FISH分析未标准化、LDH界值差异、缺少患者相关因素、其它影响预后指标如增殖指数、髓外疾病和循环中浆细胞亦未纳入。因此,推荐患者评估时,采用R-ISS和ISS联合评估,同时考虑宿主因素,如年龄、一般状态、并发症和体能状态评分等。
病例1
42岁女性,常规检查发现贫血,血总蛋白11.3g/dl,球蛋白7.7g/dl,进行性疲乏无力,行血清蛋白电泳见IgGλ5.22g/dl,血红蛋白8.3g/dl,其它免疫球蛋白受抑,肾功、血钙正常,白蛋白3.6g/dl,β2微球蛋白3mg/l。骨检查显示骨量减少,无溶骨损害。MRI未见局部损害,表现为弥漫性异常骨髓信号。骨髓活检见80%浆细胞,仅表达λ轻链。
该患者诊断为有症状ISS I期IgGλ型MM,标危,加入IFM/DFCI 2009临床研究。该研究比较了来那度胺+硼替佐米+地塞米松 (RVD)+来那度胺维持(组A,采干细胞)和RVD+自体干细胞移植 (ASCT)+RVD巩固+来那度胺维持(组B)的疗效。该患者入组B,2周期RVD后获部分缓解(PR),3周期后采干成功,行ASCT。移植后,获极好部分缓解(VGPR),2个疗程RVD巩固后进入来那度胺维持治疗,3个月后获完全缓解(CR),现来那度胺治疗84个月,耐受良好,仅有轻度疲劳和偶尔感染,持续CR状态。
病例2
61岁男性,诊断IgGκ丙种球蛋白血症,伴疲劳,血红蛋白7.6g/dl,肾功和血钙正常,β2微球蛋白2.6mg/l,白蛋白3.3g/dl,为ISS II期,IgG定量2870mg/dl,κ链73.7mg/l,与未受累轻链比为24.2。骨检查显示骨量减少、脊柱溶骨损害。骨髓活检浆细胞60%,流式检查见限制性κ链表达浆细胞,细胞遗传学正常,FISH阴性。
该患者也加入了IFM/DFCI 2009临床研究,入A组,2周期RVD诱导治疗后获VGPR,干细胞动员后进入CR状态。患者共完成8周期RVD,耐受良好,来那度胺维持治疗61个月,持续CR。
新药时代初始治疗的选择
MM新药的不断问世显著改善了OS。诱导方案应包括蛋白酶体抑制剂(PIs)和免疫调节剂(IMIDs)在内的至少3种药物是目前最佳的初始治疗选择。PIs和IMIDs联合有协同作用,可提高治疗反应,改善治疗疗效。在SWOG III期研究中,NDMM给予RVD或来那度胺+地塞米松 (Rd)治疗,RVD组的CR+VGPR率为77%,微小残留病变(MRD)阴性率65%,PFS为36个月,中位OS尚未达到。
二代PI卡非佐米+来那度胺+地塞米松 (KRD)的治疗结果也支持NDMM三药联合治疗;伊沙佐米+来那度胺+地塞米松 (IRd)对年轻适合移植患者和老年患者均显示了显著的ORR、PFS和OS,耐受良好,且全口服极为方便。大量数据显示,PIs与IMIDs联合的耐受性很好。
另一种联合治疗方案是环磷酰胺+硼替佐米+地塞米松 (CyBorD),对NDMM也有很好治疗作用,但最近研究显示含PI和IMID三药方案优于CyBorD,不过CyBorD方案对继发于轻链管型肾病的急性肾功衰竭作用很好。对于有神经病发生风险的患者,KRD方案更优,神经毒性小、有效性高。年轻患者发生心血管疾病风险较低,KRD方案同样适用。
作者观点
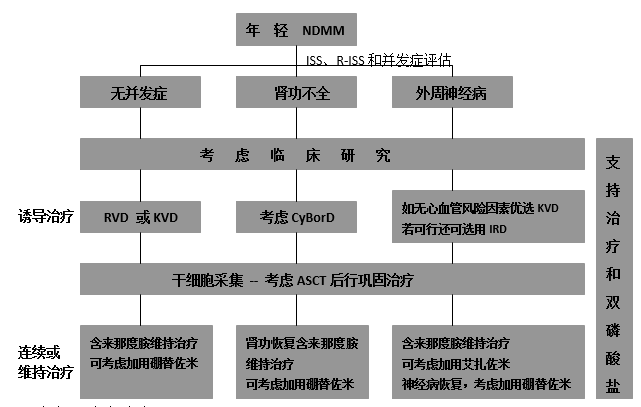
对于不适合移植或不愿参加临床试验的患者,应给予RVD治疗6-8周期作为初始治疗,也可采用其它联合治疗,如KRD、IRd、CyBorD,并采集干细胞;对于适合移植的患者,则可考虑ASCT,移植后给予维持治疗。
干细胞移植的作用
高剂量化疗后行ASCT仍是适合移植患者的标准治疗,可改善PFS和OS,但上述结论来自二药联合或不含PIs治疗的情况。三药IMID+PI+地塞米松的治疗反应深度和持续时间为上述治疗模式带来挑战,尤其是ASCT的长短期毒性,其一线治疗地位目前是一研究热点。
IFM/DFCI 2009研究的法国部分显示,移植后PFS获益明确,但OS无获益,死亡原因主要是ASCT急性毒性和继发白血病。在EMN02/HO95 III期研究中,患者接受CyBorD诱导治疗后,随机接受ASCT或硼替佐米+马法兰+强的松(VMP)治疗,强化治疗后二次随机分为巩固治疗或无巩固治疗,之后来那度胺维持治疗。3年预估PFS优于ASCT组,但OS仍无差别。
由于新药及免疫治疗对疗效的积极影响,目前很有必要明确新药时代下ASCT在MM治疗中的作用和应用时机,明确哪些患者可从移植中获益,尤其是可从早期ASCT治疗获益的患者。
作者观点
虽然ASCT仍是MM的标准治疗,但近年出现了越来越多的毒性更小的治疗手段。推荐患者参加临床研究,但对于不适合或不愿参加研究的患者,ASCT仍为合理选择。对于诱导治疗后不喜ASCT患者,获≥VGPR反应时,仍应积极进行干细胞采集。
多项研究探讨了先后双次ASCT的作用。Meta分析显示,双次移植的治疗反应率更优,但OS无差别,但其纳入研究的异质性限制了结果的可靠性。HD2研究长期随访结果显示,单次或双次ASCT的EFS和OS无差异。BMT CTN 0702研究的初期数据显示,单次ASCT+来那度胺维持治疗、单次ASCT+RVD巩固+来那度胺维持治疗、双次ASCT+来那度胺维持治疗,各组的PFS和OS相似。鉴于上述结果以及双次高剂量烷化剂的长期骨髓毒性,不推荐临床研究外的常规双次ASCT治疗。
异基因移植
清髓异基因干细胞移植 (allo-SCT)的移植相关死亡率(TRM)40-60%,年轻患者不宜使用该治疗模式。近期探讨了一线治疗时,减低剂量强度(RIC)预处理后allo-SCT与ASCT相比,也未能持续获益,且非复发死亡率更高,因此不推荐一线allo-SCT,但对于体力状态好、高危细胞遗传学的年轻患者,可考虑RIC allo-SCT挽救性治疗,宜在临床研究条件下进行。
巩固治疗
ASCT后的巩固治疗包括短疗程多药治疗,目的是改善缓解深度、延长临床获益。4项随机研究评估了ASCT后的不同巩固治疗,均可改善治疗深度,但并无OS获益。硼替佐米+沙利度胺+地塞米松 (VTD)、硼替佐米单药、RVD等方案均可用于巩固治疗,可改善PFS。
作者观点
目前临床研究显示,巩固治疗有PFS获益。因此,对于ASCT后高危患者或是未获CR的患者,应给予2-4周期RVD巩固治疗。
维持治疗和连续治疗
尽管新药和ASCT能改善患者PFS和OS,但大部分患者仍难免复发,主要源于残留疾病。因此,维持治疗的目的是延长和加深治疗反应。维持治疗为≥1年的长期治疗。研究已证实激素或干扰素维持治疗效果不佳,但新药则可能改善结果。
有研究显示,沙利度胺作为ASCT后维持治疗,因剂量及使用方案不同致治疗结果也不同,且沙利度胺具有明显的剂量-限制性毒性,如外周神经病变、静脉血栓风险、认知功能异常、疲劳和便秘。来那度胺耐受性更好,因此目前ASCT后沙利度胺只限于不能耐受来那度胺或其它药物骨髓抑制毒性的患者。
ASCT后应用来那度胺维持治疗可提高PFS 2.5年,但OS改善更显著。一项纳入1209例患者的Meta分析显示,来那度胺维持治疗带来OS获益。总体而言,ASCT后的来那度胺维持治疗获益远超过继发恶性肿瘤的风险,支持其作为ASCT后的标准维持治疗。
目前尚无硼替佐米维持治疗的安慰剂对比研究。HOVON-65/GMMG-HD4研究显示,含硼替佐米的诱导治疗后,采用硼替佐米维持治疗可改善CR率,耐受性优于沙利度胺维持治疗,对PFS和OS也有改善作用,特别是伴17p缺失患者。西班牙小组研究显示,ASCT后硼替佐米+沙利度胺与沙利度胺或干扰素维持治疗比较,前者可改善PFS,但未显示OS获益。总体而言,移植后硼替佐米维持治疗有积极作用,尤其是高危细胞遗传学患者。伊沙佐米连续治疗高危患者也产生相似获益。
作者观点
ASCT后来那度胺维持治疗是标准治疗,所有ASCT治疗患者均应接受,剂量调整应根据患者的耐受程度。高危患者,尤其是伴17p缺失时,应加入硼替佐米。不愿参加临床研究或选择延迟ASCT治疗的患者,应给予来那度胺+硼替佐米的连续治疗。关于维持治疗的持续时间目前尚无共识,理想状态应为应用至疾病进展,但具体情况而定。
免疫治疗和单克隆抗体
近年来,单克隆抗体在MM治疗上显示出极佳疗效,治疗反应质量和反应持续时间均非常突出。抗SLAMF7伊洛珠单抗单药治疗MM疗效不佳 ,但与来那度胺和硼替佐米联合则可明显改善复发难治MM的治疗反应率和PFS,毒性可控。Daratumumab单药对复发难治MM显示出良好疗效,反应率近1/3,且反应为持续性,FDA据此批准其上市。Daratumumab与IMID或PI联合,可明显改善PFS,耐受良好。上述二种单抗均尝试用于NDMM,临床获益明显,后续将进一步研究与其它多种药物的联合治疗、最佳用药顺序以及用于移植的最佳时机。
免疫检查点抑制剂在多种癌症治疗中表现出显著疗效,因此研究者也探讨了其在MM的应用。体内外研究显示,虽然PD1/PDL1抑制剂在MM中发挥作用,但单药纳武利尤单抗治疗MM的结果差强人意,但与IMIDs联合可改善其治疗活性。在帕博利珠单抗联合来那度胺或泊马度胺的临床研究中,因毒性和生存无改善而被叫停。免疫检查点抑制剂与Daratumumab和伊洛珠单抗的联合治疗研究也已启动,但鉴于帕博利珠单抗所致严重毒性,FDA叫停了部分研究。
多个其他靶点治疗的研究也在进行中,其它治疗策略如疫苗、尤其是CAR-T细胞治疗,可能会改变年轻MM患者的治疗模式。
治疗反应评估和微小残留病变(MRD)的意义
MM的反应标准与血及尿中的单克隆蛋白和骨髓结果有关,但单纯血液和形态学的CR可能低估了疾病残留。近日,IMWG将多色免疫荧光流式结果、基因测序结果和PET/CT评估骨改变结果列入反应标准,其中前二项指标的检测敏感性可达10−5。
研究证实,NDMM治疗后MRD阴性可明显改善生存,但IFM/DFCI研究显示,36个月时高达25%的MRD阴性患者复发,因此需要更敏感的方法检测MRD,而现有检测MRD的方法是否足以预测患者预后仍有质疑。新技术如单细胞基因测序和血无细胞DNA可能会更精确的评估MRD,补充了现有的MRD检测方法。目前仍需更多数据明确MRD对新药治疗后的预后作用以临床实践的指导意义。
现在MM有多种耐受良好药物可用,因此应根据治疗反应决定治疗策略,但前提是对治疗反应进行准确的动态评估,同时需要有可靠的预测结果的标志,这些均需要更多临床研究明确。
支持治疗
支持治疗包括充分水化、低强度活动、控制体重、避免肾毒性药物、预防神经病变和治疗疼痛。感染需格外关注,PI治疗时应给予阿昔洛韦或伐昔洛韦预防,减少带状疱疹病毒活化可能。IMDs治疗时,应预防血栓,低危患者每日阿司匹林(81或325 mg),可降低深静脉血栓(DVT)发生率,但仍有5%-10%的患者发生DVT。对于高危DVT患者,如伴有血栓病史、制动、肥胖、心血管疾病、吸烟等风险因素,应给予低分子肝素或华法林治疗。
无论是否检测到骨损害,均推荐静脉使用双磷酸盐,如唑来磷酸和帕米磷酸,可减少骨事件,同时也具有直接抗肿瘤作用。虽然一项近期研究未能证实4年双磷酸盐治疗的OS优于2年标准治疗,但可证实双磷酸盐治疗可减少骨事件。总之,双磷酸盐治疗获益应与其毒性相权衡,密切注意肾毒性和下颌骨坏死副作用。RANKL抑制剂狄诺塞麦在减少骨事件方面很有应用前景,尤其适合肾功不全患者。
其它支持治疗包括评估与治疗神经病变、血细胞减少和腹泻(这些均为PIs和IMID常见副作用,其中神经病变需格外重视)。
从实践出发
对资源有限及新药尚未批准用于一线治疗的国家,推荐使用最佳可用诱导治疗,优选三药方案,PI和/IMID+地塞米松+化疗。理想方案,如硼替佐米+沙利度胺+地塞米松 (VTD)或环磷酰胺+沙利度胺+硼替佐米+地塞米松(VTD+Cy)或CyBorD,使用4-6周期后行ASCT。如果治疗3-4周期,患者仍未获PR,则应在移植前使用挽救性治疗如RVD、KRD或含有单抗的方案,也可选用其它化疗方案如含蒽环类药物方案。维持治疗如双磷酸盐、沙利度胺和/硼替佐米亦应考虑,其它新药应保留至复发时应用。
结语与展望
推荐年轻NDMM治疗应尽早开始,与IMWG标准一致(图1)。诱导治疗应包括IMID和PI,同时联合激素,三药治疗增加治疗反应深度和反应质量。鉴于治疗模式的快速更新及新药联合治疗方案的不断涌现,对于初始不接受高剂量治疗的患者,ASCT可留后待用,推荐诱导治疗后连续来那度胺治疗,必要时可加用PIs。对于接受ASCT的患者,优选ASCT后巩固治疗,之后来那度胺维持治疗,高危细胞遗传学患者可考虑加用硼替佐米,其它PIs若需要也可考虑使用。
患者预后风险评估应同时采用临床和遗传学指标,细致全面的支持治疗对所有MM患者均非常重要,可避免早期并发症对后续治疗结果的影响。
图1 年轻MM患者治疗
治疗策略的制定还应考虑如下因素:后勤保障、费用、药物可及性、社会状态、并发症、患者偏好等,每个因素均可能影响治疗选择。目前MM有多种治疗可选,应根据患者具体情况选择最恰当的方案,进而改善治疗的疗效。
新的治疗方向包括单克隆抗体、疫苗、细胞治疗和联合小分子药物如组蛋白去乙酰化酶抑制剂,靶向骨病的新药如狄诺塞麦等。参加临床研究对NDMM年轻患者是最佳选择,强烈推荐。
How I treat the young patient with multiple myeloma
http://www.bloodjournal.org/content/early/2018/07/05/blood-2017-05-693606
欲了解更多血液肿瘤相关资讯,与全国各地血液肿瘤医生交流、讨论,请扫描以下二维码,备注“血液肿瘤”,添加肿瘤资讯小助手-Dinna微信!
28个肿瘤相关临床试验招募患者
点击下方图片即可查看详情