背景
AACR 2019 | 帕博利珠单抗联合仑伐替尼,或将重新定义肝癌一线治疗
美国癌症研究协会(AACR)年会是全球历史最悠久、规模最大的肿瘤研究学术会议之一。会议关注高质量肿瘤研究及创新的各个方面,是全球肿瘤研究的焦点,汇集了肿瘤领域最前沿的研究成果。3月29日—4月3日,2019年AACR年会在美国亚特兰大召开,今年的主题为“综合性癌症科学•全球影响•个性化患者护理”。在本次的AACR大会上,免疫治疗依然是大会的热点。其中一项Ⅰb期研究报道了帕博利珠单抗联合仑伐替尼治疗不可切除肝细胞癌的安全性和疗效,这是继2018年美国临床肿瘤学会(ASCO)年会后,再次报道该研究的更新结果,证实免疫联合靶向治疗安全性良好,且疗效颇具前景。
研究内容介绍
肝癌是全球第二大癌症死因,每年导致近74.5万人死亡。肝细胞癌(HCC)是最常见的原发性肝癌,约占全球所有肝癌的80%。仑伐替尼是一个多靶点酪氨酸激酶抑制剂,靶向VEGFR1-3、FGFR1-4、PDFGR-α、RET和KIT。基于仑伐替尼对比索拉非尼治疗不可切除HCC显示出非劣效性的REFLECT研究,仑伐替尼已获批晚期HCC一线治疗适应证。而抗PD-1单抗帕博利珠单抗单药已经在全球获批用于多种实体瘤,包括HCC的二线治疗。
血管内皮生长因子(VEGF)通过抑制树突状细胞成熟下调T细胞活化,降低肿瘤中的T细胞浸润和增加肿瘤微环境中的免疫抑制细胞,从而介导免疫抑制效应。使用靶向VEGF或VEGFR的抗血管生成抑制剂后,有望改善肿瘤微环境,提高免疫治疗的疗效。在小鼠肝癌模型的研究中发现,仑伐替尼在免疫活性小鼠中的抗肿瘤活性优于其在免疫缺陷小鼠中的抗肿瘤活性,且随着CD8+ T细胞的耗竭,抗肿瘤活性减弱。在免疫活性小鼠中,仑伐替尼联合抗PD-1单抗治疗相比于两药单用,肿瘤退缩更明显,缓解率显著更高。单细胞RNA测序分析显示,仑伐替尼联合或不联合抗PD-1单抗,可以降低单核细胞和巨噬细胞的比例,增加γ干扰素诱导的CD8+T细胞比例。这些数据提示,仑伐替尼具有免疫调节活性,与抗PD-1单抗联合使用具有协同作用,会增加抗PD-1单抗的疗效。基于此,研究者设计了此项仑伐替尼联合帕博利珠单抗治疗不可切除HCC的研究。
方法
这项开放的Ⅰb期研究,入组了不可切除的HCC,要求患者的BCLC分级为B或C级,Child-Pugh分类为A类,ECOG PS 0~1分,至少有一个按改良的实体瘤疗效评价标准(mRECIST)可测量的靶病灶。患者接受仑伐替尼12mg(体重≥60kg)或8mg(体重<60kg)口服,每天1次;联合帕博利珠单抗200mg,静脉用药,每3周1次。研究分为2个部分,第1个部分采用3+3设计,入组了6例无其他合适治疗方案的患者,并在治疗第1周期时评估联合用药的耐受性。耐受性采用剂量限制性毒性(DLT)评估,结果显示6例患者均未观察到剂量限制性毒性。在确立了仑伐替尼联合帕博利珠单抗的耐受性后,开始第2部分研究(扩展期),入组了既往未接受过系统性治疗的不可切除HCC患者24例。研究的主要终点为安全性,选择性的次要和探索性终点包括总缓解率(ORR)、疾病控制率(DOR)、无进展生存(PFS)、至进展时间(TTP)、总生存时间(OS)和帕博利珠单抗治疗时产生的抗药抗体。研究者根据mRECIST评价疗效,独立评估委员会根据mRECIST和RECIST 1.1标准评价疗效。
图1. 研究设计
结果
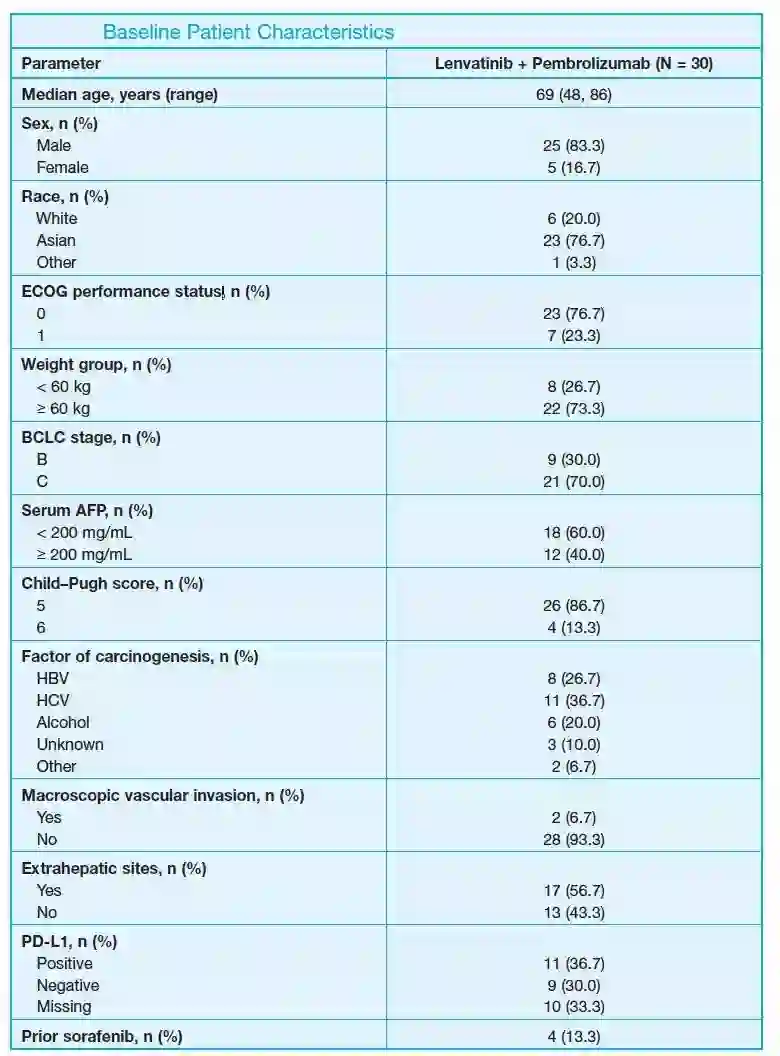
研究共入组30例患者接受仑伐替尼联合帕博利珠单抗治疗(第1部分6例;第2部分24例)。BCLC分期B期或C期的患者分别为9例和21例;Child-Pugh评分5分或6分的患者分别为26例和4例,患者的基线特征总结见表1。
表1. 患者的基线特征
2018年的ASCO年会上,研究者报告了该研究的初步结果。截至2018年3月22日,入组的30例患者中,23例仍在接受研究治疗。安全性结果显示:30例患者中,治疗后发生的不良事件(TEAE)最常见为食欲减退(53.3%)、高血压(53.3%)、腹泻(43.3%)和乏力(40.0%),未出现预期外的安全性信号。疗效结果显示:在纳入疗效分析的26例患者中,1例(3.8%)获完全缓解(CR)、10例(38.5%)部分缓解(PR),ORR(包含已确认和待确认的)达到42.3%,其中已确认的ORR为26.9%(26例中有7例);中位至缓解时间为1.41个月;中位PFS 9.69个月。仑伐替尼联合帕博利珠单抗表现出良好的安全性和有希望的疗效。
本次AACR大会上,研究者公布了该研究的更新数据。至2018年8月23日数据截止时,18例(60%)患者仍在接受研究药物治疗,中位随访时间为9.7个月。最常见的TEAE为食欲减低(63%)和高血压(60%),未观察到新的不良事件。
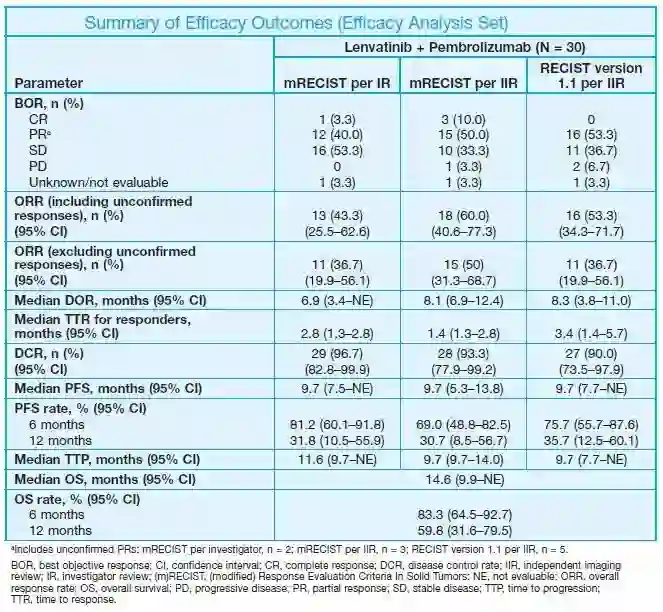
肿瘤应答分别由研究者按mRECIST和独立评估委员会按mRECIST和RECIST 1.1进行评估。30例患者纳入疗效分析,研究者和独立评估委员会采用mRECIST标准评价的CR率分别为3.3%和10.0%,PR率分别为40.0%和50.0%。值得一提的是,相比于2018年ASCO大会上公布的数据,本次更新的数据中,研究者采用mRECIST标准评价,已确认的ORR从26.9%提高到36.7%,已确认取得客观缓解的患者从7例增加到11例。此外,独立评估委员会采用mRECIST标准评价,ORR高达60%(包含已确认和待确认的),疾病控制率DCR 93.3%(表2)。
表2. 患者的疗效数据总结
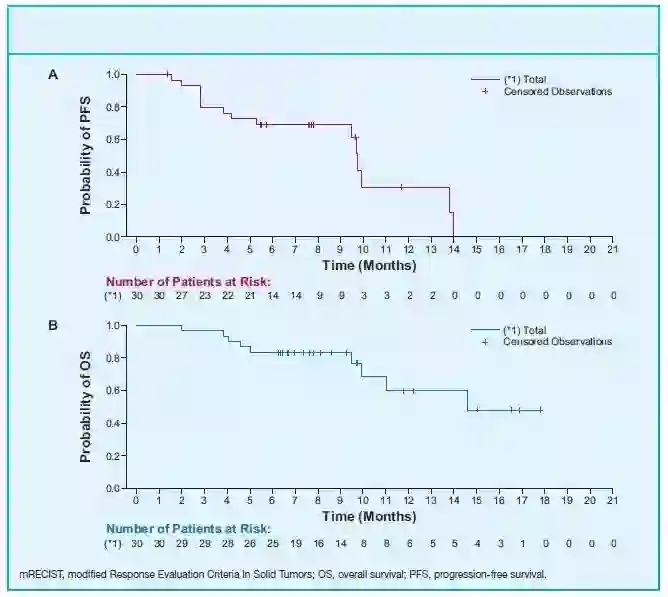
图2. 独立评估委员会按mRECIST评估的(A)PFS和(B)OS
结论
在不可切除的HCC患者中,仑伐替尼联合帕博利珠单抗显示出有前景的抗肿瘤疗效和可耐受的安全性。目前基于这一研究结果,已经对研究方案进行修改,计划在第2部分总共入组100例患者,以进一步验证该治疗方案。基于这一研究结果,目前也已经启动了帕博利珠单抗联合仑伐替尼一线治疗晚期HCC的全球Ⅲ期随机对照临床研究,中国由秦叔逵教授牵头开展,目前也已经启动。
这一初步研究结果证实了抗PD-1/L1单抗联合抗血管生成治疗这一组合有前景的疗效和安全性。除此之外,也有多项PD-1/L1单抗联合抗血管生成治疗的临床研究正在进行。例如在2018年ESMO大会上,也报道了一项ⅠB期研究,评估了阿特珠单抗联合贝伐珠单抗治疗不可切除或晚期HCC的安全性和疗效,同样取得了较好的疗效和安全性,两药联合方案安全耐受,ORR为32%。目前还有多项研究在进行中,期待抗PD-1/L1单抗和抗血管生成治疗这一联合方案能够继续在更广泛的人群中进行进一步研究,为不可切除或晚期HCC患者带来疗效更优的一线治疗选择。
专家点评
解放军东部战区总医院全军肿瘤中心主任
中国临床肿瘤学会(CSCO)副理事长
北京希思科临床肿瘤学研究基金会理事长
国家卫健委肝癌专家组组长
中国抗癌协会癌症康复与姑息治疗专委会主任委员
全军医科委理事兼肿瘤专委会副主任委员
基于CheckMate-040研究和KEYNOTE-224研究的结果,美国FDA先后有条件地批准了纳武利尤单抗和帕博利珠单抗用于既往接受过索拉非尼治疗的晚期肝细胞癌。由此,肝癌治疗已经进入了免疫治疗的新时代。除了用于二线治疗,PD-1单抗能否前移至一线治疗肝癌呢?从现有的初步研究结果看来,PD-1单抗单药用于肝癌一线治疗的有效率有待提高,起效时间也偏晚,急需探索联合治疗和积极探寻生物标志物。
目前,免疫检查点抑制剂联合化疗和免疫检查点抑制剂联合血管靶向药物已成为有关研究的热点。从2018年ASCO年会以及本次2019年AACR年会上公布的更新数据来看,仑伐替尼联合帕博利珠单抗治疗晚期肝癌的Ⅰb期研究取得了令人鼓舞的结果,两药相辅相成、协同增效显著,包括第三方独立评估的ORR达到60%, 疾病控制率高达93.3%,而mOS和mPFS都明显延长。巳进一步开展国际多中心的Ⅲ期临床试验,中国20家中心积极支持和参与,两周前已经全面启动,值得我们满心期待。
现在,免疫联合治疗肝癌的尝试颇多,可谓花样变幻、层出不穷,在鼓励此类研究的同时,还应该强调有目的、有计划和合理的联合治疗研究,而不是简单或随便地把两个药甚至更多的药放在一起,揽到碗里便是菜,那样只是胡乱“杂合”,研究风险极大,失败不是意外。既往某些联合治疗研究获得成功,并不代表任意将抗PD-1/PD-L1单抗联合各种靶向药物都会成功,在临床上也必须拥有可靠的循证医学证据才可以推广使用。免疫治疗的新时代,正在走向“精准、联合、多样化”,更需要精心设计、认真实施和严格质控临床研究,方可能获得成功,提供更多的、高级别和充分的临床依据。
1. Ikeda M, Sung M W, Kudo M, et al. A phase Ib trial of lenvatinib (LEN) plus pembrolizumab (PEM) in patients (pts) with unresectable hepatocellular carcinoma (uHCC) [R]. 2018 ASCO, 4076.
2. Ikeda M, Sung M W, Kudo M, et al. A phase Ib trial of lenvatinib (LEN) plus pembrolizumab (PEMBRO) in unresectable hepatocellular carcinoma (uHCC): Updated results. 2019 AACR, CT061/18.
41本肿瘤患者指南丛书
点击下方图片即可免费阅读
70个肿瘤相关临床试验招募患者
点击下方图片或识别图片二维码即可查看详情