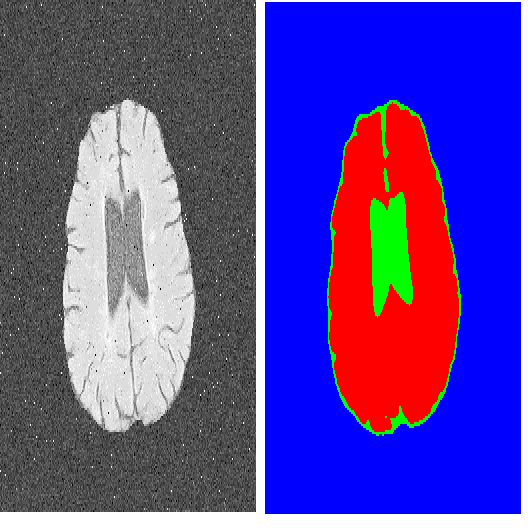
Deep learning models usually suffer from domain shift issues, where models trained on one source domain do not generalize well to other unseen domains. In this work, we investigate the single-source domain generalization problem: training a deep network that is robust to unseen domains, under the condition that training data is only available from one source domain, which is common in medical imaging applications. We tackle this problem in the context of cross-domain medical image segmentation. Under this scenario, domain shifts are mainly caused by different acquisition processes. We propose a simple causality-inspired data augmentation approach to expose a segmentation model to synthesized domain-shifted training examples. Specifically, 1) to make the deep model robust to discrepancies in image intensities and textures, we employ a family of randomly-weighted shallow networks. They augment training images using diverse appearance transformations. 2) Further we show that spurious correlations among objects in an image are detrimental to domain robustness. These correlations might be taken by the network as domain-specific clues for making predictions, and they may break on unseen domains. We remove these spurious correlations via causal intervention. This is achieved by resampling the appearances of potentially correlated objects independently. The proposed approach is validated on three cross-domain segmentation tasks: cross-modality (CT-MRI) abdominal image segmentation, cross-sequence (bSSFP-LGE) cardiac MRI segmentation, and cross-center prostate MRI segmentation. The proposed approach yields consistent performance gains compared with competitive methods when tested on unseen domains.
翻译:在深度学习模型中,通常存在域偏移问题,即在一个源域上训练的模型不能很好地泛化到其他看不见的域。本文研究了单源域泛化问题:在只有一个源域的情况下训练一个抗击未知域的深层网络。我们将此问题应用于交叉域医学图像分割中。在这种情况下,域偏移主要由不同的数据采集过程引起。我们提出了一种简单的因果驱动的数据增强方法,通过合成具有领域偏移的训练样本来使分割模型对它们进行学习。具体而言,我们采用一系列随机加权的浅层网络来增广训练图像,使深度模型能够抵抗图像强度和纹理上的差异。此外,我们表示,在图像中对象之间的错误相关性对领域的鲁棒性是有害的。神经网络可能将这些相关性视为领域特定的线索来进行预测,从而破坏泛化性能。我们通过因果干预来消除这些错误的相关性。这是通过独立地重采样可能相关的对象的外貌来实现的。我们的方法在三个交叉域分割任务上进行了验证:交叉模态(CT-MRI)腹部图像分割,交叉序列(bSSFP-LGE)心脏MRI分割和交叉中心前列腺MRI分割。与其他竞争方法相比,所提出的方法在未知域上的表现始终有一致的性能提高。