核酸自组装纳米结构的肿瘤靶向治疗研究获进展
化疗是治疗癌症的主要手段之一,顺铂和卡铂等铂类化合物作为一线化疗药物被广泛应用于癌症的临床治疗。铂类药物的抗肿瘤活性主要基于其与DNA的共价或非共价作用,这类相互作用是没有细胞选择性的,因而在利用铂药进行化疗的过程中会出现严重的毒副作用,包括肾毒性、耳毒性和神经毒性等。发展新的铂药给药策略以提高疗效并降低毒副作用的研究一直以来都广受关注。自组装的DNA纳米结构具备优异的生物相容性,并且能够在肿瘤区域富集。通过合理地设计,多种功能性配体能够精确地组装在DNA纳米结构上,从而制备出多功能性的纳米药物运输载体。
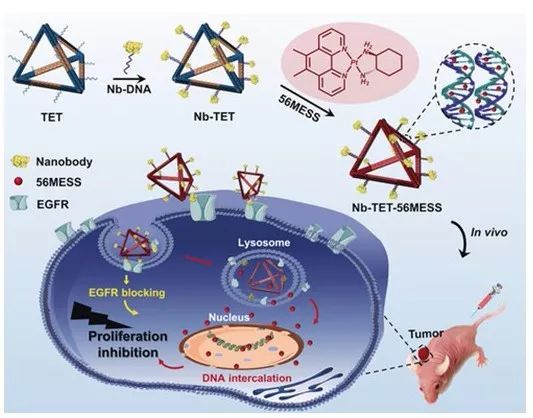
中国科学院国家纳米科学中心丁宝全课题组在多功能核酸自组装结构递送小分子药物领域已获得一系列进展(J. Am. Chem. Soc. 2012, 134, 13396; ACS Nano 2014, 8, 6633; Nano Lett. 2018, 18, 3328; Angew. Chem. Int. Ed. 2018, 57, 15486)。这些多功能的DNA自组装载体实现了药物的高效递送,表现出了优异的肿瘤治疗效果。在最近发表的研究工作中,丁宝全课题组与中科院化学研究所研究员肖海华及中国科学技术大学教授刘扬中合作,首次将具备结合表皮生长因子受体功能的纳米抗体精准定位组装在DNA四面体结构上,并在纳米抗体修饰的DNA四面体中通过非共价分子间作用装载具有芳香环结构的铂药56MESS,制备具有主动靶向功能的铂药递送体系。该体系在活体水平表现出优异的肿瘤抑制效果,并极大地降低铂药的毒副作用。该研究成果以A Nanobody-Conjugated DNA Nanoplatform for Targeted Platinum Drug Delivery 为题被Angew. Chem. Int. Ed. 杂志在线发表(2019, DOI: 10.1002/anie.201909345)。
铂药基于纳米运输载体提高癌症治疗效果的研究已经被广泛报道,借助脂质体、聚合物胶束、无机纳米材料和蛋白质纳米颗粒等纳米材料,铂药能够在肿瘤部位大量富集,从而更好地发挥肿瘤抑制效果。目前,以自组装的核酸纳米材料作为铂药递送工具的研究鲜有报道。核酸自组装结构具备优异的生物相容性,非常适用于对小分子化疗药物的递送研究。选择具备优异的靶向性、稳定性和易修饰性的纳米抗体作为靶向配体,将偶联DNA的纳米抗体定位组装到DNA四面体上,使DNA纳米结构具备靶向性。再将具有芳香环结构的铂药56MESS以嵌插的方式高效负载到靶向修饰的DNA纳米结构中。在纳米抗体的作用下,该体系能够靶向过表达表皮生长因子受体的肿瘤细胞,增加了细胞对DNA纳米载体的摄取。除此之外,纳米抗体与受体的结合能够降低肿瘤细胞表面表皮生长因子受体的含量,在一定程度上进一步抑制肿瘤细胞的增殖。小鼠活体实验结果表明,该类DNA自组装给药体系表现出非常好的肿瘤抑制效果,并且极大地避免了小分子铂药严重的毒副作用。
论文由国家纳米中心博士生武田田与助理研究员刘建兵担任共同第一作者,通讯作者为丁宝全。该研究得到国家自然基金委和中科院前沿科学重点研究计划等的支持。
负载铂药的自组装DNA四面体结构,在纳米抗体引导下被肿瘤细胞摄取并在胞内释放铂药,实现肿瘤生长抑制
来源:中国科学院国家纳米科学中心
温馨提示:近期,微信公众号信息流改版。每个用户可以设置 常读订阅号,这些订阅号将以大卡片的形式展示。因此,如果不想错过“中科院之声”的文章,你一定要进行以下操作:进入“中科院之声”公众号 → 点击右上角的 ··· 菜单 → 选择「设为星标」