Science:脂肪细胞外泌体对巨噬细胞发挥调节功能
脂肪组织是能量储存的主要部位,其响应营养物可用性的波动以维持全身代谢稳态。脂肪细胞从血液中吸收循环游离脂肪酸(free fatty acids, FFA)并将其储存在脂滴中,以响应胰岛素浓度增加;然后它们在营养缺乏的条件下水解脂质以释放FFA。脂肪组织中存在多种其他细胞类型,包括成纤维细胞、内皮细胞和脂肪组织巨噬细胞(adiposetissue macrophages, ATM)。ATM除了在免疫监视和清除细胞碎片中的作用外,对于脂质缓冲和调节健康和患病状态下的脂肪组织功能都很重要。由于全球慢性肥胖和相关健康问题的发病率不断上升,人们对了解脂肪组织在生理和病理环境中的功能有了新的兴趣。肥胖会激活免疫系统,导致2型糖尿病、非酒精性脂肪性肝病和其他疾病。了解脂肪组织如何调节免疫反应可促进代谢紊乱和其他肥胖相关疾病的新治疗和预防策略的发展。
最新一期的Science杂志上,哥伦比亚大学的Flaherty等报道脂肪细胞通过释放称为脂肪细胞衍生的外泌体(AdExos)的不同类别的细胞外囊泡(EVs)与脂肪组织巨噬细胞进行通信,这种细胞外囊泡载有脂肪,直接源自脂肪细胞脂滴。脂肪组织巨噬细胞对AdExos的吸收实现了脂质的直接转移,在免疫功能和新陈代谢中起作用,揭示了一种细胞间通讯和营养交换形式,对肥胖相关病症机理的揭示具有重要意义。
脂肪组织中的脂肪细胞将过量的卡路里储存为甘油三酯(一种脂质)。脂肪细胞将甘油三酯分解成称为脂肪酸的较小脂质,脂肪酸被释放到血液中以满足身体的能量需求。
在之前的研究中,Ferrante教授的实验室发现,除脂肪细胞外,脂肪组织还含有许多免疫细胞,包括大量的巨噬细胞。在其他组织中,巨噬细胞吞噬并破坏病原体。“长期以来,我们一直试图弄清楚这些免疫细胞在脂肪中的作用,”Ferrante教授说。几年前,他的研究小组发现,脂肪中的巨噬细胞吸收并“消化”大量脂质。他和其他人认为这些脂质来自甘油三酯的分解产物。
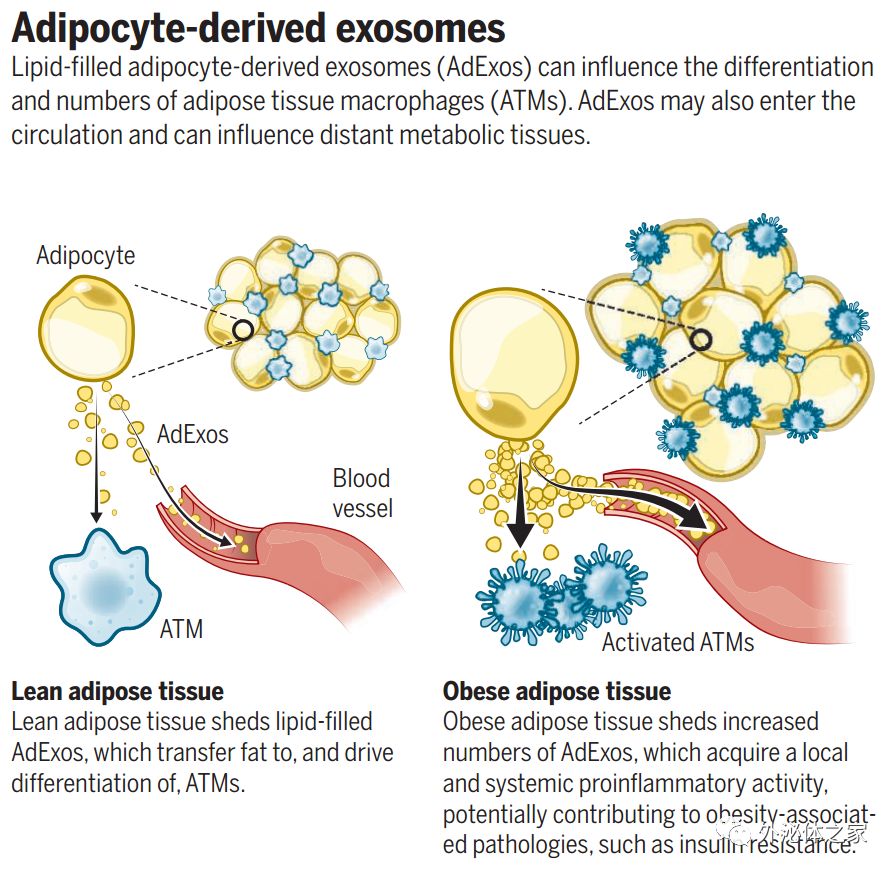
在目前的小鼠研究中,研究人员发现脂肪细胞不仅释放出甘油三酯的脂肪酸成分;它们还释放出包装成小颗粒的完整甘油三酯。这些称为脂肪细胞外泌体(adipocyte exosomes, AdExos)的脂质填充颗粒被脂肪中的巨噬细胞摄取。巨噬细胞迅速分解AdExos中的甘油三酯并将其作为脂肪酸释放,Ferrante教授假设其可以在脂质循环中被脂肪细胞摄取,脂质循环用新鲜脂质补充脂肪细胞。“在骨骼中存在类似的机制,其中破骨细胞——另一种类型的巨噬细胞——将骨骼分解成钙和磷酸盐,用于制造新鲜骨骼。这个周期对骨骼健康至关重要。我们现在想知道在脂肪中是否发生类似的循环保持健康,”Ferrante教授指出。
此外,研究人员发现,AdExos似乎可以控制免疫细胞的发育。科学家们对巨噬细胞如何发展组织特异性功能没有一个清晰的认识。但Ferrante和他的团队发现,AdExos可能在“教育”免疫细胞方面发挥核心作用,诱导骨髓细胞发育成消化和回收脂质的巨噬细胞。有趣的是,AdExo颗粒也在血液中被发现,提高了它们可能在脂肪组织外产生影响的可能性。“我们的下一步是研究这些脂质颗粒是否出现在人类身上,如果是这样,它们是否对我们在循环和代谢疾病中测量的脂质有贡献,”Ferrante说。
直径30-150 nm的外泌体和直径0.2-2.0 μm的微泡(MV)构成两种主要类型的EVs。外泌体和MV均可由多种细胞类型形成和释放,并含有多种成分,包括蛋白质、RNA转录物、microRNA、甚至DNA片段。当这些生物活性内容物转移到其他细胞时,会引起细胞活动和生物过程的变化。EVs的影响已经在疾病进展的背景下进行了最广泛的研究,特别是癌症,它们促进癌细胞生长、治疗抵抗、侵袭和转移。Flaherty等人的研究增加了EVs在调节生理过程中的重要性的新观点。实际上,AdExos不仅将脂肪从脂肪细胞传递到ATMs,而且还促进骨髓祖细胞分化为ATM样巨噬细胞,突出了这种形式的细胞间通讯如何通过影响常驻细胞类型来调节组织功能。
在脂肪组织中存在的各种细胞类型中,Flaherty等人发现体内AdExos的摄取和随后的细胞内脂质积累几乎完全发生在ATMs中。这种选择性摄取的一种可能机制是吞噬作用。然而,Flaherty等人发现在骨髓衍生的祖细胞中,AdExos通过巨胞饮作用摄取,提高了其他因子可能指导其受体细胞的结合和摄取的可能性。这可能类似于癌细胞脱落的外泌体,其外表面上含有细胞粘附蛋白,如整合素,从而使它们能够特异性地靶向并帮助建立转移的二级位点。
在喂食和禁食期间,由小鼠脂肪细胞产生的AdExos的数量急剧上升和下降,但是相对于其瘦小鼠对照而言,这种释放速率在肥胖小鼠中一直维持在较高水平。这一发现很有意义,因为肥胖人群中脂肪组织的特征是由大量增加的ATMs引起的慢性低水平炎症,以及从抗炎M2巨噬细胞亚型转变为促炎性M1亚型。这与各种疾病有关,包括II型糖尿病、心血管疾病和癌症。
虽然Flaherty等人关注AdExos在脂肪组织中的局部作用,脂肪细胞衍生的外泌体也可具有全身作用。具体而言,当静脉注射到瘦小鼠体内时,脂肪组织来源的外泌体主要被外周血单核细胞吸收,促进细胞因子释放和巨噬细胞活化,导致全身性胰岛素抵抗。相比之下,在瘦个体中,脂肪组织在葡萄糖耐量中起重要作用,作为循环外泌体miRNA的主要来源,其调节远处代谢组织(包括肝脏)的功能。由于Flaherty等人使用的特定分离方法,尚不清楚AdExos或脂肪细胞是否释放具有不同生物学功能的不同类别的EVs。此外,最近发现脂肪组织内皮细胞是生物活性EVs的另一种来源,其响应于全身营养状态的变化而释放。因此,EVs介导的细胞间信号传导和营养交换的复杂网络似乎存在于脂肪组织内以及脂肪组织和体内远处部位之间。
总之,这揭示了一种新兴的模式,其中脂肪组织EV介导脂肪细胞、免疫细胞和代谢器官之间的信号和营养物的交换,从而有助于瘦个体体内的全身代谢稳态。然而,肥胖的发作破坏了这种平衡,脂肪组织EVs获得了促炎活性,这可能导致慢性健康状况,例如胰岛素抵抗。Flaherty等人的研究通过鉴定一类充满脂质的EVs来提供对脂肪组织生物学的新见解,这些EVs绕过脂质动员的规范途径,建立可能对脂肪组织稳态很重要的脂质循环。
关于不同类型的EVs的生物化学定义,特别是它们如何装载特定的蛋白质和核酸成分,什么类型的细胞外信号影响它们的大小和组成成分,仍有许多待解析。它们通过将货物转移到受体细胞从而改变受体细胞生化活动和遗传程序。AdExos转移脂质还有一些问题有待解决,包括AdExos如何从脂滴中获得、它们如何针对特定细胞类型、它们的货物如何促进分化、以及它们在肥胖过程中如何改变其功能。实际上,进一步了解脂肪组织EVs的生理和病理生理作用增加了调节EV功能以治疗慢性肥胖相关疾病的前景。
参考文献:
StephenE. Flaherty III, Ambar Grijalva, Xiaoyuan Xu, Eleanore Ables, Alireza Nomani, Anthony W. Ferrante Jr. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science 01 Mar 2019: Vol.363, Issue 6430, pp. 989-993 DOI: 10.1126/science.aaw2586
MarcA. Antonyak, Michael J. Lukey, Richard A. Cerione. Lipid-filled vesicles modulate macrophages. Science 01 Mar 2019: Vol. 363, Issue 6430, pp. 931-932 DOI:10.1126/science.aaw6765
【科研成长加油站】
临床数据预测模型类论文专题研讨会 (2019/3/23-24 北京)
R语言挖掘科研数据发表论文(2019/03/16-17 上海;2019/03/23-24 北京 )
SCI论文插图规范化操作高级研讨会(03/15-17 上海 ;03/22-24 北京)
中药复方发表SCI如何突破5分大关(2019年3月16日-17日 广州)
系统评价与meta分析学习班(3.21-24 上海)和临床科研设计和数据管理学习班(3.26-28 上海)
大会日程公布—2019基因编辑学术研讨会 | 2019. 3. 30~31 北京
TCGA、GEO及SEER公共数据库挖掘与应用学习会 2018年3月23-24日 上海
回复“外泌体” 阅读外泌体最新科研进展及动态
回复“EV” 阅读 2016-2018年This Week in Extracellular Vesicles
回复“盘点” 阅读 外泌体领域十大前沿进展盘点