【1789】【Lancet Oncology】MAGE-A3免疫治疗方案兵败晚期黑色素瘤辅助治疗领域
随着新的治疗手段如雨后春笋般出现,将癌症控制为慢性病的愿望正渐渐变为现实,特别是PD-1抑制剂帕博利珠单抗(Pembrolizumab)治愈卡特总统的故事,更是给广大黑色素瘤病人带来了强烈的希望。但是,治愈毕竟是极少数,转移性黑色素瘤依然是人类健康的一大威胁,广大病人对新治疗方法的需求依然迫切。近日,Brigitte Dreno等人公布了他们使用MAGE-A3免疫治疗方案作为辅助治疗处理ⅢB或ⅢC期黑色素瘤的临床试验(DERMA)结果[1],能否带来新的治疗选择呢?
作为最具侵袭性的皮肤癌症,恶性黑色素瘤的治疗效果一直不理想,特别是ⅢB期和ⅢC期的恶性黑色素瘤,其5年生存率仅为35-60%,虽然通过手术对病灶进行完全切除是黑色素瘤治疗的一种重要方法,但是Ⅲ期黑色素瘤往往皮损范围相当巨大,且同时存在淋巴结和其他脏器的转移,这一系列特性使得手术方案的治疗效果差强人意,而针对此类病人的辅助治疗,如扰素-α和聚乙二醇化干扰素,虽然可以改善病人的无复发生存率,但对总体生存率的影响却微乎其微,且临床试验结果与用药的剂量、持续时间和目标人群的调查结果也有着很大的关系[2]。虽然辅助性伊匹木单抗(ipilimumab)治疗可以明显改善Ⅲ期黑色素瘤患者的无复发生存率和总生存率,但半数以上患者在治疗期间会出现Ⅲ-IV级的药物毒性反应,甚至一些病人会由于这些治疗相关不良反应而死亡[3],可见其治疗耐受性并不令人满意。
那么,晚期黑色素瘤的治疗是否就一直这样不容乐观呢,当然不是。已经有研究证明,纳武利尤单抗(nivolumab)能够明显延长ⅢB、ⅢC和Ⅳ期黑色素瘤患者的无复发生存期,同时相较于伊匹木单抗,纳武利尤单抗严重副作用的发生率也明显更低[4]。而另一项研究也已经证明,达拉非尼(BRAF抑制剂)和曲美替尼(MEK抑制剂)联合使用,能够显著降低存在BRAFV600 E或BRAFV600 K突变的III期黑色素瘤患者的复发和死亡的风险[5]。
作为一种肿瘤抗原, MAGE-A3 在超过76%的黑色素瘤患者中都有表达,且除了胎盘和睾丸,MAGE-A3 不在正常的人体细胞中表达,这也就为针对MAGE-A3 进行肿瘤免疫治疗提供了理论依据。通常来说,这种免疫治疗通过对病人注射AS15(GSK,免疫刺激剂)重组的MAGE-A3蛋白进行,用以刺激针对MAGE-A3的特异性免疫反应。这之前进行的针对转移性黑色素瘤MAGE-A3治疗的2期临床试验中,研究人员已经证明分别有7%和14%的病人能够获得客观疗效和稳定病情。可见,这种免疫治疗方式在黑色素瘤的治疗领域仍存在一定的潜能,因此,Brigitte Dreno等人进行了名为DERMA的临床研究,旨在评估MAGE-A3 免疫治疗在晚期黑色素瘤治疗应用上的价值。
基本情况
本次临床试验(DERMA)是一项在31个国家的263个治疗中心中开展的随机双盲安慰剂对照3期临床试验,参加本次研究的病人均未身患ⅢB或ⅢC恶性黑色素瘤的成年人,并且都存在肉眼可见的淋巴结转移,基本状态评分为0或1,肝肾功能正常,在随机治疗前的9周内表现为手术治疗后的无疾病状态,并且在试验开始前就已经从之前的治疗中完全恢复。所有病人都被按照2:1的比例分配到两个治疗组中,组1使用MAGE-A3免疫疗法(每名病人共接受13次AS15重组MAGE-A3(300 μg MAGE-A3抗原加 420 μg CpG 7909 重组于AS01B,共0.5ml)肌肉注射),组2则使用安慰剂进行对照,整个治疗过程持续27个月,前5次治疗间隔3周进行,后8次治疗则是每12周进行1次。在整个治疗过程中,患者的用药剂量不允许减少,但是如果患者出现了严重的疾病,则可以中断或延迟治疗。如果患者出现了以下任何一种状况,则立即停止试验:疾病复发;接受其他抗癌治疗;治疗后出现3级以上过敏反应;任何不能忍受或持续的,且可能由于继续治疗而进一步加重的中度以上不良反应;免疫系统功能紊乱(白癜风除外)的体征或症状;任何免疫缺陷或抑制状态;患者无法完成研究评价;病人要求退出试验;女性患者怀孕或决定尝试怀孕。
在整个治疗期间。研究人员每3个月对病人进行一次疗效评估,主要通过胸部和上腹部的CT扫描或胸部X光检查结果进行。在每次随访过程中,研究者对每名病人都进行了详细的身体检查和临床评估,必要时会采用脑部CT或MRI对病人进行检查。研究人员计划对所有参与试验的病人进行持续且积极的随访,从而评估从第一次治疗开始,往后至少5年的生存和疾病复发情况。
每次治疗后记录31天内(第0天~第30天)的治疗相关不良反应。从研究开始到治疗结束的整个过程中,都详细记录了严重的不良反应发生情况,包括了所有与研究药物相关或GSK药物相关的严重不良事件。自第一次治疗期,记录5年的新发病的自身免疫性疾病和妊娠情况。对于治疗和每个不良反应之间潜在的因果关系,研究人员也都进行了仔细的评估。同时,在血液系统和肝肾毒性评估方面,研究人员在第12周和第12, 24和30个月进行了血液学参数和肝肾功能安全性的实验室检测。
主要终点为MAGE-A3免疫治疗在总体人群和GS(基因签名)阳性人群中的无病生存期。次要终点为GS阴性患者的无病生存期,总体人群、GS阴性和GS阳性患者中的总体生存期,1, 2, 3和4年的无疾病生存率,无远处转移生存期, MAGE-A3免疫原性,同时,通过无病生存期和基因特征状态,以及不良反应和自身免疫反应的发生情况,来验证目标基因的预测疗效价值。
治疗效果
从2008年12月1日到2011年9月19日,研究人员共对3914名病人进行了筛选,最终有894名病人被分到了MAGE-A3组,450名病人被分到了安慰剂组,且治疗结果可用于评估。在MAGE-A3组中,88%的病人接受了至少4个周期的治疗,而安慰剂组的450名病人中,这一数字为403人(90%)。
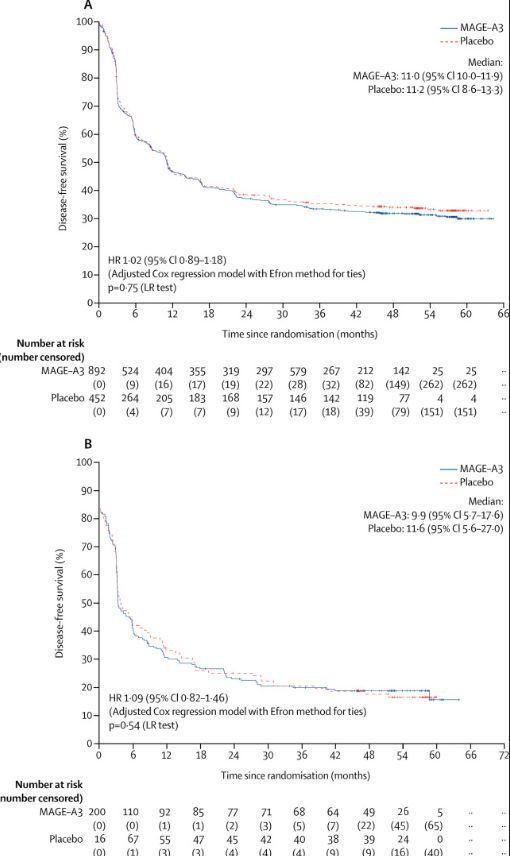
截止最后一次无病生存期分析时(2013年5月23日),共有856名病人发生病情的复发或死亡,其中MAGE-A3组572人(64%),安慰剂组284人(63%),两组的平均随访时间分别为28个月和28.1个月,平均无病生存期分别为11个月和11.2个月。
为了分析寻找合适的能够评估预后的目的GS,研究人员将366名病人分为训练组(training set),将729名病人分为测试组( test set),发现一个新的包含39个基因的GS与MAGE-A3免疫治疗的效果有着很大的关系,39-GS阳性患者使用MAGE-A3免疫治疗可能能够获得更好的疗效。但是,当研究人员使用这种GS评价标准对测试组的700多名病人进行评估时却发现,在39-GS阳性的患者中,接受MAGE-A3免疫治疗和接受安慰剂治疗的无病生存期分别为9.9个月和11.6个月,这似乎说明这种新的GS对治疗效果额评估并不十分准确。
在无病生存率方面,MAGE-A3免疫治疗组的1年、2年、3年和4年数据分别为47%, 37%, 33%,和31%,而安慰剂组的此项数据则分别为47%, 39%, 35%, 和33%。
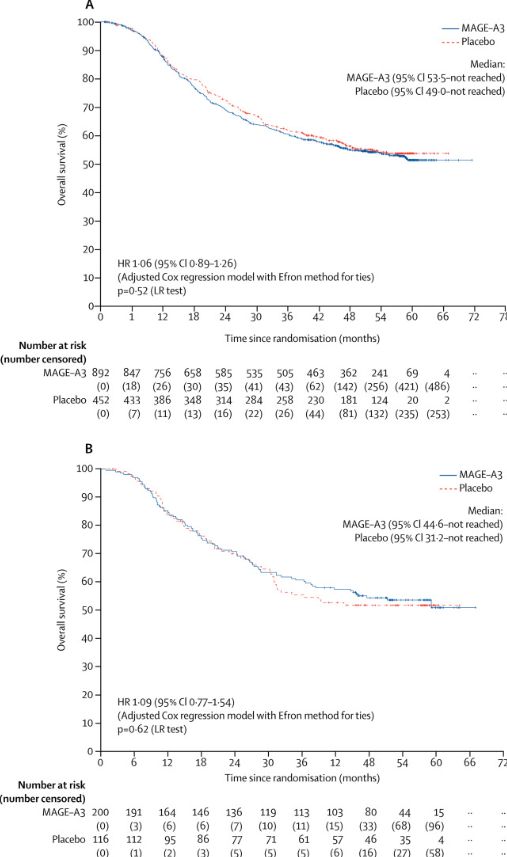
到最后一次数据分析为止(2013年5月23日),共有467名患者死亡,其中MAGE-A3组314人(35%),安慰剂组153人(34%)。安慰剂组的平均总体生存期为46.6个月,而MAGE-A3组仍未采集到数据,通过调整后的Cox回归模型分析,两组的HR为1.07(0.88-1.29,P=0.52)。在GS阳性病人组中,两组的总体生存情况也没有很显著的差异。
随着MAGE-A3免疫治疗的开始,血清中抗MAGE-A3抗体和抗蛋白D抗体的浓度都迅速增高,并且在整个治疗过程中都保持在一个比较高的水平。进一步的个亚型分析也发现,几乎所有亚型的病人都没有从MAGE-A3治疗中获益。
不良反应
在不良反应方面,MAGE-A3组894名患者中有822人(92%)在31天内出现了治疗相关不良反应,而安慰剂组中则有334人(74%)。最常见的不良反应为发热、注射部位疼痛和流感样症状,所有这些不良反应MAGE-A3组都要比安慰剂组更为常见。MAGE-A3组中,126名(14%)患者的不良反应为3级以上不良反应,而安慰剂组这一数据为56人(12%),31天内两组治疗相关3级以上不良反应的发生率分别为4%和1%。MAGE-A3组和安慰剂组分别有14人(12%)和5人(1%)因副作用而中止了试验。
讨论
本次临床试验是首次将MAGE-A3免疫治疗应用于恶性黑色素瘤治疗的3期临床试验,其结果证实了这种免疫方案能够有效的提高血液中MAGE-A3抗体的浓度,但是这种血液学水平上浓度的增加并不能高效的转化为显而易见的治疗效果,这与之前MAGRIT研究(MAGE-A3免疫治疗非小细胞肺癌失败)的结果一样[6]。虽然本次临床试验具有一定的局限性,但是无论在哪个治疗效果评估指标方面,MAGE-A3免疫治疗都不能给晚期黑色素瘤病人带来明显的治疗收益,而研究人员推测出现这种现象的原因可能与特异性T细胞诱导(特别是CD8细胞应答)的缺乏有关。新的治疗方案仍有待进一步拓展,而肿瘤治疗领域的突破依旧任重而道远。
1. Dreno, B., et al., MAGE-A3 immunotherapeutic as adjuvant therapy for patients with resected, MAGE-A3-positive, stage III melanoma (DERMA): a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol, 2018.
2. Garbe, C., et al., Adjuvant low-dose interferon {alpha}2a with or without dacarbazine compared with surgery alone: a prospective-randomized phase III DeCOG trial in melanoma patients with regional lymph node metastasis. Ann Oncol, 2008. 19(6): p. 1195-201.
3. Eggermont, A.M., et al., Prolonged Survival in Stage III Melanoma with Ipilimumab Adjuvant Therapy. N Engl J Med, 2016. 375(19): p. 1845-1855.
4. Weber, J., et al., Adjuvant Nivolumab versus Ipilimumab in Resected Stage III or IV Melanoma. N Engl J Med, 2017. 377(19): p. 1824-1835.
5. Long, G.V., et al., Adjuvant Dabrafenib plus Trametinib in Stage III BRAF-Mutated Melanoma. N Engl J Med, 2017. 377(19): p. 1813-1823.
6. Vansteenkiste, J.F., et al., Efficacy of the MAGE-A3 cancer immunotherapeutic as adjuvant therapy in patients with resected MAGE-A3-positive non-small-cell lung cancer (MAGRIT): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol, 2016. 17(6): p. 822-835.
28个肿瘤相关临床试验招募患者
点击下方图片即可查看详情