方法:
最新全基因组测序研究一览:深入了解肿瘤基因图谱及发现新的潜在治疗靶点
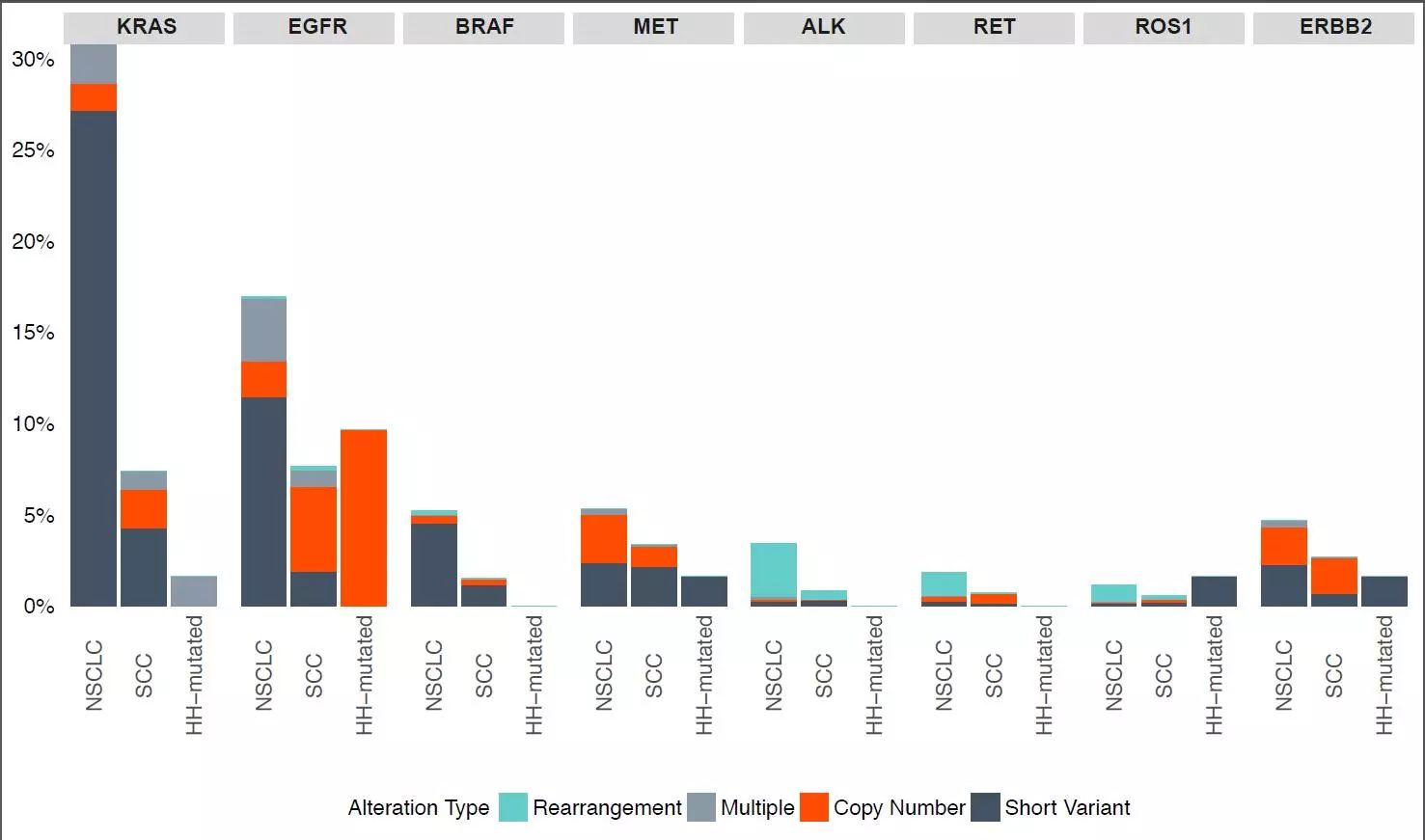
EGFR突变的发现和EGFR TKI的应用,拉开了肺癌靶向治疗的序幕。EGFR TKI的临床研发之路,奠定了基于分子标志物进行治疗的热潮,这一研究思路也很快被再次验证。随后,越来越多的NSCLC分子治疗靶点问世,ALK、ROS1、BRAF……肺癌的靶向治疗可谓癌症精准治疗的典范。回眸过去10余年肺癌治疗的发展史,我们清楚的意识到精准检测的重要性。Foundation Medicine(以下简称FMI)针对实体瘤的全面基因组测序(CGP)产品可一次检测315个基因,同时还可以提供TMB(肿瘤突变负荷)及MSI 信息,此外,FMI还针对血浆样本建立的检测平台。CGP检测在发现新的治疗靶点,探寻耐药机制及预后生物标志物等方面提供了重要信息。在本届的WCLC会议上报道了众多相关研究,采用FMI CGP (Comprehensive Genomic Profiling,全面基因组测序)检测靶向治疗或免疫治疗耐药的患者,探寻潜在的耐药机制,指导后续治疗。以下汇总全面基因组测序深入了解肿瘤基因图谱及发现新的潜在治疗靶点的研究进展。
#9520. 对MET基因簇状扩增和非簇状扩增的NSCLC患者进行全面基因组分析
MET是一个跨膜的受体酪氨酸激酶,MET基因变异的方式包括突变、扩增、重排或过表达。目前,针对MET活化已经开发出很多的治疗药物,包括单抗类药物和酪氨酸激酶抑制剂(TKI)。原发的MET基因扩增是NSCLC的驱动基因。既往的研究提示,MET基因扩增的NSCLC患者(未检测到其他MET变异形式)对克唑替尼治疗敏感,MET抑制剂用于NSCLC患者的临床研究正在进行。获得性的MET基因扩增可以介导EGFR突变患者对EGFR TKI的耐药,目前,在一代、二代、三代EGFR TKI耐药的患者中,MET基因扩增都介导了部分患者的耐药。目前,关于检测MET基因扩增或过表达的方法包括免疫组化(IHC)、荧光原位杂交(FISH)和二代测序(NGS),然而要明确MET作为真正的驱动基因的检测方法和检测cut-off值尚未确立。既往的研究提示,NSCLC患者中MET基因扩增的发生率为1-5%,不同人群、不同检测方法、不同的评价标准,导致MET基因变异发生率报道不一。目前,一些临床研究已经探索了MET抑制剂用于MET变异的NSCLC患者中的疗效。
既往,有些研究采用基于MET IHC检测的表达分数的方法,来筛选MET抑制剂的获益人群,但结果以失败告终。一项采用FISH法筛选MET扩增患者的I-II期临床研究显示,MET基因中度扩增的患者,接受克唑替尼治疗的有效率为17%(1/6),MET基因高度扩增患者的有效率为50%(3/6),如下图所示。
图:不同MET基因扩增患者接受克唑替尼治疗的疗效
MET基因位于7号染色体,全长125kbp,MET基因扩增定义为拷贝数≥6个。根据MET基因扩增片段的大小分为簇状扩增和非簇状扩增。簇状MET扩增定义为扩增片段<20Mbp,扩增片段占据7号染色体的比例<15%,通常只包含一个或几个基因。大的非簇状或“广泛”(扩增片段>20Mbp),扩增片段占据7号染色体很大一部分,包括了大量的扩增基因。
结果:
本研究采用杂交捕获的CGP检测,共检测18200例NSCLC患者,其中MET基因扩增的患者545例。MET扩增拷贝数≥6个,在NSCLC患者的发生率约为3%。545例患者中,其中457例(84%)为簇状扩增(扩增片段<20Mbp),扩增片段的中位长度为2Mbp,88例(16%)患者为非簇状扩增,扩增片段的中位长度为46Mbp。MET扩增子的大小范围为0.095 – 158 Mbp;第25%,50%和75%分位数分别为1.63 Mbp, 3.46 Mbp, 和 11.66 Mbp。MET扩增子的大小分布如下图。
图:MET扩增子的大小分布
MET基因拷贝数的范围位6-144,中位拷贝数位10。簇状扩增的患者中,MET基因的中位拷贝数为11,非簇状扩增患者,MET基因的中位拷贝数为7,两者有统计学差异(P<0.001)。
图:不同MET扩增子的拷贝数
对比簇状和非簇状MET扩增患者的肿瘤突变负荷(TMB),中位TMB分别为11 vs. 9mut/Mb,两组无统计学差异(P=0.47)。
图:不同MET扩增子患者的TMB
进一步对比簇状扩增和非簇状扩增患者,其他共存基因的发生率。结果显示,相比簇状扩增患者,MET非簇状扩增患者中,有更高比例患者合并共存基因。总体而言,MET簇状扩增患者和非簇状扩增患者中,合并其他驱动基因变异的患者比例分别为33%和51%,这说明NSCLC的驱动基因还是存在互斥现象。其中,MET exon14外显子跳跃突变和EGFR突变是最常见的共存基因,在簇状扩增患者中的比例分布为8%和16%;在非簇状扩增患者中的比例为10%和23%。KRAS在两组患者中的共存比例分布为8%和14%。其他NCCN指南推荐检测的驱动基因,在MET簇状扩增患者中的共存比例显著低于MET非簇状扩增患者,分别为<0.5% vs. 5.7%。共存可能代表了一部分患者为获得性耐药患者。
图:对比簇状扩增和非簇状扩增患者其他共存基因的发生率
会上,Sai-Hong Ignatius Ou教授还分享了1例临床病例。一位55岁的亚裔女性肺腺癌患者,2015年被诊断为晚期肺癌, EGFR exon19del突变。合并脑转移,进行了脑部转移灶切除术,对脑转移病灶进行CGP检测发现EGFR exon19del突变+MET基因非簇状扩增,9个拷贝数。患者接受了阿法替尼治疗3个月后进展,最佳疗效PR,在疾病进展后,重新对进展的肺部转移灶进行活检,发现为SCLC转化。CGP检测发现肺转移灶为EGFR exon19del+MET基因非簇状扩增,无T790M突变。患者后续因为SCLC转化接受EP方案化疗,反应良好,因为脑转移接受奥希替尼治疗。对于这例患者,是否因为共存的MET基因变异导致阿法替尼的疗效持续时间较短?但阿法替尼取得了PR的疗效,这说明EGFR exon19del突变仍然是这个患者的驱动基因,而非簇状扩增的MET基因在这例患者中不是驱动基因。
小结:
在MET扩增的NSCLC患者中,MET扩增子的大小存在很大的变异。关于MET基因“簇状扩增”和“非簇状扩增”的准确cut-off值需要后续更多的研究,需要联合分析患者接受MET TKI的疗效及MET FISH法检测的拷贝数(MET/CEP7)。一方面,如果cut-off值定义的太过保守(如定义扩增片段为2Mbp),这部分人群较少,会排除很大一部分可能从MET TKI治疗中获益的患者;另一方面,如果cut-off值定的太宽松,又有可能包括一部分不能从MET抑制剂治疗中获益的患者,这将会影响药物的疗效,影响药物的临床研发。本研究提示,临床实践中,采用CGP检测MET基因的拷贝数是评估MET扩增的好方法。
#10599. 对vismodegib治疗敏感的肺鳞癌患者进行全面基因组测序,发现了hedgehog通路的改变
肺鳞癌的发病与吸烟有关,但关于非鳞癌的癌症起源过程却知之甚少。肺鳞癌起源于麟状细胞化生,而其他部位的鳞癌起源于生理性的鳞癌上皮细胞。肺鳞癌相比于皮肤鳞癌,平均肿瘤负荷更低,但比食管和头颈部鳞癌更高,这也反应了不同解剖部位的肺鳞癌基因的多样性。此外,3q25基因的扩增在肺鳞癌患者中很常见,但在其他解剖部位的鳞癌患者中不常见,因此,3q25基因可能是与鳞状上皮化生有关的基因序列。
图: 比较不同部位鳞癌患者的TMB
1例77岁的男性肺鳞癌患者,吸烟史40包年,诊断为基底细胞样鳞癌,复发进展为晚期后,患者接受了3线治疗均很快进展,其中包括nivolumab治疗的快速进展和参加了一个临床研究。对肝转移病灶进行CGP检测发现PTCH1基因突变,TMB<2m/mb(TMB低)。因为患者有PTCH1突变,给予患者vismodegib治疗,效果较好,疗效持续时间为10个月。基于这位患者的治疗经验,研究者回顾性分析他们医院9例基底细胞样鳞癌患者,1例(11%)患者检测到PTCH1突变,即为这例接受治疗的男性患者。
研究者进一步分析了FMI数据库中的肺鳞癌患者,2563例肺鳞癌患者中, PTCH1突变率为1.48%(38例)。相比于PTCH1野生型患者,PTCH突变患者的共存突变基因分布大致相似。此外,PTCH1突变患者和野生型患者的TMB相当,中位TMB分布为11.5m/Mb和9.0m/Mb。详细分析38例PTCH1突变的患者,26例患者为截断点突变,7例为错义突变,3例为剪接突变,2例为框移缺失。38例突变患者中,29例可以进行杂合性丢失(loss of heterozygosity,LOH)评估。纯合的LOH患者,10/15为截断点突变;杂合的LOH,12/15为截断点突变。
进一步对Hedgehog通路的其他基因进行检测,结果显示,SMO(7次跨膜蛋白,PTCH1的受体)和SUFU(负性调节剂)的突变率分布为0.12%和0.98%,两个突变基因互斥,且与PTCH1突变互斥。临床前研究显示,SMO突变对SMO抑制剂,如vismodegib的疗效反应不一。SUFU突变对SMO抑制剂无反应。目前,在皮肤基底细胞癌(BCC)中,对PTCH1、SMO和SUFU基于突变的研究最多,三者的突变率分别为73%、20%和8%。尽管肺基底细胞样鳞癌与皮肤BCC在组织学类型上有相似性,但肺基底细胞样癌中未检测到SMO和SUFU突变,PTCH1突变率为11%(开头的病例报道)。
此外,进一步分析PTCH1突变和NSCLC其他驱动基因的共存情况,如EGFR突变和ALK重排。结果显示,PTCH突变与这些驱动基因有相互排斥的趋势。PTCH1突变还与肺鳞癌中其他常见变异基因,如3q25和FGF12/SOX2/PIK3CA扩增子(在肺鳞癌中的变异率为25%)相互排斥。
图:腺癌,鳞癌和Hedgehog突变的肺癌中常见驱动基因的变异频率
小结:
PTCH1在肺鳞癌中的发生率为1.5%。尽管在组织学上,肺基底细胞癌和皮肤BCC有相似性,但是肺基底细胞鳞癌中,PTCH1突变发生率是否很高,目前仍然未知。1例PTCH1突变的肺鳞癌患者,对vismodegib治疗敏感。目前,除PTCH1突变外,并没有其他更优的生物标志物可以预测SMO抑制剂的疗效,LOH可能是一个有意义的分子标志物。PTCH1突变与其他肺鳞癌中常见的扩增子互斥,这提示,PTCH1突变的肺鳞癌有其独特的进化途径,尤其是和3q25扩增的患者相比。
#10454. 在NSCLC患者中检测到ERBB受体反馈抑制剂-1的变异
ERBB受体反馈抑制剂-1(ERRFI-1)编码MIG6,可以负性调节EGFR和ERBB2信号通路。ERRFI-1基因失活可能会引发肿瘤,然而,ERRFI-1变异是否对靶向治疗敏感还有待研究。既往,在NSCLC患者中,没有研究报道过ERRFI-1突变率以及ERRFI-1突变的NSCLC患者是否对EGFR和/或ERBB2的靶向抑制剂敏感。
本研究分析了FMI数据库中的19,347例NSCLC患者, 这些患者既往进行了杂交捕获的全面基因组组测序。结果显示ERRFI-1截断突变的发生率为0.62%(120/19,347)。不同组织学类型的NSCLC患者,突变率相当,分别为:腺癌(0.7%)、鳞癌(0.3%)、大细胞癌(0.8%)、腺鳞癌(0.6%)、肉瘤样癌(0.6%),其他未定型NSCLC(0.6%)。共存突变包括:P53 突变(59%),KRAS突变(19%),EGFR exon 19del突变(9.2%),EGFR L858R突变(3.3%),EGFR T790M突变(3.3%),EGFR扩增(6.7%),ERBB2突变(7.5%)和ERBB2扩增(3.3%)。
会上,研究者分享了两例ERRFI-1突变的患者。1例58岁的老年女性,吸烟40包年,右肺上叶癌,伴纵隔,肺,骨和脑转移。病理类型腺癌,ERRFI-1框移突变,其他NSCLC驱动基因均为野生型。一线接受阿法替尼单药治疗,疗效持续时间3个月。三线接受西妥昔单抗单药治疗,疗效持续时间5个月。
图:接受阿法替尼治疗过程中的影像学变化
另一例75岁的女性非吸烟患者,右肺上叶癌,伴纵隔淋巴结转移,右侧胸膜转移。病理为腺癌,ERRFI-1截断突变,其他NSCLC驱动基因均为野生型。二线接受厄洛替尼治疗最佳疗效PR,疗效持续时间8个月。
小结:
ERRFI-1在NSCLC患者中的突变率为0.5%左右,是潜在可治疗靶点,在不同组织学类型的NSCLC患者的均可见,可以与EGFR活化突变共存。后续有必要对进行这部分患者进行EGFR靶向治疗的临床研究。
#10169. 肺肉瘤样癌的全面基因组测序
肺肉瘤样癌(PSRC)是一类少见的原发性肺癌,侵袭性强。采用CGP检测可以探寻患者潜在的治疗靶点和预测免疫治疗的敏感性。本研究采用CGP探索肺肉瘤样癌潜在的治疗靶点。研究检测了10例肉瘤样癌未定型,5例肺动脉内膜肉瘤,2例多形性肉瘤,1例原发性IMT和1例原发性SFT。19例患者的分期分别为:I期1例,II期1例,III期9例,IV期8例。患者的中位年龄位52岁(范围33–81岁),女性7例,男性12例。平均的基因变异数(GA)为5.7。常见的,但无靶向药物治疗的基因变异包括:TP53(53%),CDKN2A (32%),CDKN2B (27%)和RB1 (21%)。检测到的临床有意义的基因变异包括PDGFRA突变、RICTOR突变、CDK4突变和KIT突变(发生率均为11%);EGFR突变、TSC2突变、ALK重排和BRAF突变(发生率均为5%);9 例(47%)PSRC患者至少检测到≥1个临床有意义的基因变异。1例IMT患者检测到ALK融合。1例患者检测到SMARCA4基因失活突变和杂合性丢失。患者的平均TMB为8.65mut/Mb (16%的患者TMB> 10mut/Mb;11%的患者TMB>20mut/Mb) ;TMB>20mut/Mb的患者,未检测到临床有益的基因变异。7例患者进行了微卫星状态检测(n=7),均为微卫星稳定。目前,正在评估对这些患者进行相应的治疗干预。
小结:
肺肉瘤样癌是一类非常罕见的原发性肺肿瘤,对其进行CGP检测提示这类患者有相对较高基因变异频率,且发现了很多潜在可靶向治疗的靶点,如驱动基因突变和酪氨酸激酶区的融合以及细胞周期调节基因等。此外,CGP检测还发现有一部分肉瘤样癌患者的TMB中度或高,提示这类患者可能从免疫治疗中获益。后续需要更多的研究采用CGP检测肺肉瘤样癌患者,并验证相应的治疗靶点。
总结
以上4项研究,采用CGP对NSCLC患者进行基因检测,不仅可以深入了解肿瘤基因图谱,包括罕见病例亚型,而且可以发现新的潜在治疗靶点。
1. Genomic analysis of non-small cell lung cancer (NSCLC) cases with focal and non-focal MET amplification. 2017 WCLC, abs9520.
2. Genomic profiling reveals hedgehog pathway alterations in vismodegib sensitive lung squamous cell carcinoma. 2017 WCLC, abs10599.
3. ERBB receptor feedback inhibitor-1 alterations in non-small cell lung cancer. 2017 WCLC, abs10454.
4. Pulmonary sarcomas: A comprehensive genomic profiling study. 2017 WCLC, abs10169.
28个肿瘤相关临床试验招募患者
点击下方图片即可查看详情