ESMO 2017重要研究结果荟萃——免疫治疗进展
1144O-随机III期临床研究,在手术后的NSCLC患者中评估辅助化疗联合免疫治疗的疗效
背景:过继性的细胞免疫疗法目前并没有广泛获批用于癌症治疗。我们这一随机III期临床研究的初步结果既往已经进行过报道,手术后的NSCLC接受化疗+免疫治疗,相比单纯辅助化疗,可以给患者带来生存获益。自此,我们报道这一研究长期随访后的最终结果。
方法:研究共入组103例手术后的NSCLC患者,随机分配接受化疗联合免疫治疗(A组,简称免疫治疗组,n=51),或化疗组(B组,对照组,n=51)。免疫治疗包括输注来自于患者局部淋巴结的激活的杀伤T细胞和树突状细胞。
结果:A组和B组2年的生存率分别为96.0% vs. 64.7%;5年的生存率分别为69.4% vs. 45.1%。多变量分析显示HR=0.451(95%CI:0.235-0.807)。A组和B组2年的无复发率分别为70.0% vs. 43.1%;5年的无复发生成率分别为57.9% vs. 31.4%,log-rank检验两组有统计学差异,P=0.0059。总生存的亚组分析显示,男性(HR=0.474),腺癌(HR=0.479),III期癌症患者(HR=0.399),术前没有接受过化疗的患者(HR=0.483),患者的死亡风险低于对照组。对接受免疫治疗的患者,进行局部淋巴结细胞表面标志物分析,结果显示,癌症幸存者中,CD8+/CD4+ T细胞的比例升高。
结论:过继细胞免疫用于NSCLC术后患者的辅助治疗是有益的。细胞表面标志物的免疫分析提示,细胞毒性T细胞是预测患者能够从化疗联合免疫治疗中获益的标志物。
1135O- IB/II期临床研究SCORES:在晚期实体瘤和头颈部鳞癌患者中,初步探索durvalumab联合AZD9150或AZD5069的安全性,耐受性和抗肿瘤活性
背景:既往已经证实抗PD-L1单抗durvalumab,可以逆转肿瘤患者的免疫抑制状态,重新激活机体的抗肿瘤免疫。STAT3抑制剂AZD9150(简称STATi),CXCR2的小分子抑制剂AZD5069(简称CX2i)和CTLA4抑制剂tremelumumab(简称T)均为在研的药物。
方法:第一部分,先在实体瘤中进行剂量爬坡研究,评估STATi +(D 或D+T)和CXC2i +(D或D+T)的安全性,药代动力学,药效学和最大耐受剂量。第二部分,在头颈部鳞癌患者中,进行剂量扩展队列研究,在既往接受过/未接受过PD-L1抑制剂单药治疗的患者中,评估STATi(3mg/kg)+D和CX2i(40mg BID)+ D两个方案的客观缓解率(ORR)和疾病控制率(DCR)。
结果:第一部分结果显示STATi+D和CX2i+D是安全耐受的联合方案,在多个实体瘤患者中,取得了确认的PR,且在2例乳腺癌和前列腺癌患者中观察到确认的CR(治疗时间>64周)。STATi+D方案在肉瘤患者中,12周评估确认为PR。第二部分(仅报道STATi+D方案的疗效),在既往没有接受过PD-L1抑制剂治疗的患者中,ORR为25%(4例确认的PR,1例未确认的OR;3例患者为HPV阴性,2例患者状态未知);12周的DCR为45%(9/20),在25周时,仍有30%(6/20)在接受治疗。在最后截止日期,1例确认为PR的患者评价为未确认的CR。在既往接受过PD-L1抑制剂治疗的患者中,1例患者为完全的代谢环节,1例患者为未确认的PR;12周的DCR为20%(3/15)。在头颈部鳞癌患者中,STATi+D方案的安全性和耐受性得到确认,毒副作用可管理,且可逆,主要表现为血小板介绍和肝酶升高(58例患者中,3-4度不良事件发生率分别为3.4%和3.4%)。STATi+D方案中有2例患者因为治疗相关的AE停药。
结论:初步的研究结果显示,PD-L1抑制剂联合抗肿瘤微环境中免疫抑制相关因子的抑制剂,相比于PD-L1单药,可以提高ORR和DCR。目前的研究结果显示,这一联合方案用于既往接受过或未接受过PD-L1抑制剂治疗的头颈部鳞癌患者,显示出较好的耐受性,是一个有效的治疗选择。目前,正在头颈部鳞癌和其他实体瘤患者中进行后续研究。
1136O-Nivolumab联合ISA 101 HPV疫苗用于不可治愈的HPV-16+相关肿瘤
背景:单独应用靶向HPV相关的疫苗并不能使得肿瘤缓解。目前的观点认为,联合免疫检查点抑制剂,可以使得疫苗诱导的T细胞扩增效应增强,为了验证这一假说,我们进行了这一II期研究,在不可治愈的HPV-16+肿瘤中,评估ISA101(合成的长肽HPV-16疫苗)联合nivolumab的疗效。
方法:采用 Cervista HPV16/18检测肿瘤为HPV-基因型16阳性。患者ECOG PS评分0-1分,既往接受过至少一线的挽救治疗。分别在第1天,22天和50天,给予ISA101 100 mcgs/peptide治疗,从第8天开始给予nivolumab 3 mg/kg,iv,q2w治疗,持续1年。分别在基线,11周,之后每6周进行1次影像学评估。主要的研究终点为ORR,预期为30%;次要研究终点包括耐受性,PFS和OS。采用Simon两阶段设计,药物第一阶段的ORR为2/15,第二阶段为5/25。
结果:研究入组24例患者,22例为喉癌(OPC),口腔癌和宫颈癌各1例。18例(75%)的患者既往在接受铂类治疗后6个月内进展,1例患者既往未接受过铂类治疗。12例(50%)的患者接受过西妥昔单抗治疗。复发后一线治疗的患者10例(10/24),二线治疗的患者14例(14/24)。ORR为33%(8/24):1例CR,7例PR(其中1例未确认),3例(13%)SD,13例(54%)PD。在OPC患者中,ORR为36%(8/22)。8例PR的患者中,6例既往接受铂类治疗后6个月内进展。中位的疗效持续时间为30.1+周(6-49+周);8例PR的患者中,5例仍持续缓解。中位的无进展生存期为2.7个月(95%CI:2.3-8.0)。6个月的PFS率为33%(16-52%);6个月的OS率为74%(51-87%)。毒性:3度转氨酶升高和4度血脂升高的患者各1例;1-2度毒性:发热(5例),注射部位反应(6例),出现转氨酶升高,乏力和恶心的患者各有3例。
结论:研究达到了主要研究终点,OPC患者中的ORR为36%,相比于CheckMate141研究中,nivolumab单药用于P16+OPC的患者,ORR为16%。这一研究提示,疫苗诱导的T细胞效应可以被抗PD-1单抗增强,逆转免疫抑制的肿瘤微环境。我们的研究结果需要在更大样本量的随机研究中进一步验证。会上将会报道肿瘤的免疫细胞浸润状态和患者疗效的关系。
1137O- III期研究ADAPT的中期分期,评估个体化的免疫治疗,rocapuldencel-T细胞疗法(AGS-003)用于初治转移性肾细胞癌(mRCC)患者的疗效
背景:R-T是一个探索性的免疫疗法,从患者肿瘤中分离RNA,去编码带有肿瘤特异性抗原的树突状细胞。通过皮下注射的慢性刺激,来激活肿瘤特异性的记忆T细胞反应。
方法:III期研究ADAPT旨在评估rocapuldencel-T细胞疗法联合标准一线方案(SOC)对比SOC用于初治mRCC患者的疗效,主要终点为OS。这一研究在北美,欧洲和以色列地区的107个研究中心进行,入组透明细胞型mRCC患者。
结果:2013年2月至2015年1哦月,共入组462例患者,2:1随机分配。2017年2月,在完成预期290个事件数(死亡)的75%后,由独立评估委员会进行中期分析,建议终止研究。因为OS的HR值大于预先设定的第3次中期分析的无效界值(0.98)。然而,在与研究者和FDA讨论会,研究的赞助方决定继续进行这一研究,因为生存数据还未完全成熟,且rocapuldencel-T的作用机制包括长期诱导免疫记忆细胞的免疫反应,且该疗法比较安全。中位随访时间为20个月,目前两组各仍有一般以上的患者仍然存活。来自前3/4入组患者的数据分析(n=154),这部分患者的随访时间最长,且删失数据最少(44%),提示联合治疗方案有潜在生存获益的可能,值得继续评估。此外,且接受了7次rocapuldencel-T治疗的患者中(n=114),由rocapuldencel-T的诱导的记忆T细胞(CD8+/CD28+/CD45RA-)的数目和患者的OS有显著相关性。在会上将会报道长期的疗效和免疫分析的相关数据。
结论:ADAPT研究是一个正在进行的研究,旨在评估这一耐受性良好的个体化免疫治疗的长期疗效。
1138PD- 采用全面基因组测序(CGP)预测NSCLC患者接受免疫检查点抑制剂的疗效和耐药机制
背景:在晚期NSCLC患者中预测免疫检查点抑制剂的疗效是研究的热点,也有非常重要的临床意义。本研究在真实世界中,通过CGP和 PD-L1的IHC检测,来预测免疫检查点抑制剂的疗效。
方法:研究采用CGP和IHC法检测了FMI标本库中1619例NSCLC患者的FFPE标本。采用SP142来检测肿瘤细胞PD-L1的表达。同时,CGP检测数据库中2139例NSCLC,并单独分析真实世界中PD-L1的IHC结果。CGP采用杂交捕获技术,对>=50ng 的DNA标本进行检测,中位测序深度>600X;在1.1Mb测序DNA上检测TMB(mut/Mb)。
结果:IHC法检测的PD-L1表达与TMB(FMI标本)弱相关(相关系数 0.085,P<0.001);平均TMB为10.9mut/Mb;中位TMB为8.1mut/Mb,且14.5%的患者TMB高(定义为>=20mut/Mb)。从FMI-FIH的数据来看,TMB高而非PD-L1表达状态能够预测更长的治疗疗程(P=0.001)。通过分析FMI和FMI-FIH的数据库,解释了GA,PD-L1表达,TMB和平均治疗疗程的关系。STK11非活化突变在FMI-FIH标本和FMI标本中的发生率分别为12.1%和15.1%,多见于腺癌患者。STK11突变于高TMB/PD-L1低表达相关(FMI标本;P=0.0014);初步的分析显示,其与免疫检查点抑制剂的疗效呈负相关。常见的与SKT11突变共存的基因包括:KRAS(54.5%),TP53(43%),CDKN2A(27.5%),CDKN2B(20.1%),KEAP1(18.9%)和MYC(13.5%)。BRAF突变,通常见于腺癌,与免疫治疗疗效相关,且无论患者的TMB状态(FMI-FIH;P=0.0073)。MET突变也与免疫检查点抑制剂的疗效相关,但因为目前数据还不成熟,未看到两者直接有显著的统计学意义(FMI-FIH)。从TCGA肺腺癌数据库来看,MET突变(发生率2.8%)与免疫活化基因的表达相关(P<0.05);而STK11突变(14.2%)与免疫逃逸的基因表达相关(P<0.05)。
结论:尽管TMB可以独立预测患者接受免疫检查点抑制剂治疗的疗效,不受PD-L1表达水平的影响,但综合分析TMB,PD-L1表达以及SKT11,BRAF或MET突变的状态,可能可以更好的精准筛选免疫治疗优势人群。
1139PD-采用真实世界的临床基因数据库分析肿瘤免疫治疗的疗效预测标志物
背景:目前关于免疫治疗疗效预测的确切标志物,尚未明确。在大样本量的真实世界接受免疫治疗的人群中分析患者的临床基因特征,可能可以更好的发现优势人群。
方法:研究入组了Flatiron健康分析数据库中,接受了Foundation Medicine CGP检测的2139例NSCLC患者。CGP检测包括了>300个癌症基因和肿瘤突变负荷(TMB)。TMB分为3类:低(TMB-L;<6mt/MB);中(TMB-I;6-20mut/MB);高(>=20mut/MB)。PD-L1表达由患者所在医院的实验室检测(采用不同的抗体)。将基因检测数据和患者的电子病例系统数据联系起来,nivolumab的疗效评价为ORR(ORR=SD,PR,或CR),中位疗效持续时间(DOT)和中位OS(分别自诊断为晚期肿瘤开始计算或自nivolumab使用开始计算)。
结果:在接受nivolumab治疗的患者中(n=111,20.8%),TMB-H相比于TMB-L/I预示着更长的中位疗效持续时间(7.5 vs. 4.6个月,P=0.001),更长的mOS(自nivolumab使用开始计算:未达到 vs. 10个月,P<0.01),更长的mOS(自诊断为晚期肿瘤开始计算:65 vs. 29个月,P=0.10)。然而,PD-L1表达水平(n=282)和患者的ORR,DoT或OS无相关性。在PD-L1表达阴性的患者中,TMB-H预示着更长的DOT(mDOT 391 vs 166 天, p = 0.08)和更高的ORR(TMB-H的患者 100%[n=5] vs. TMB-L/I的患者62%[n=28])。在调整了患者的组织学类型,年龄,分期,吸烟史、性别和种族的多因素分析后,TMB仍然是能够预测DOT和OS(自nivolumab使用开始计算)的独立预测因子。在TMB-L的患者中,发现了2个额外的可以预测nivolumab治疗持续时间的基因标志物:BRAF (HR 0.12, p = 0.04), 和BRCA 1/2 (HR 0.05, p = 0.01)。
结论:采用真实世界的数据库,结合患者的临床结局和基因检测结果,可能以帮助我们寻找免疫检查点抑制剂治疗的优势人群。本研究显示,TMB可以作为疗效预测的重要因素,相比于当地实验室进行的PD-L1表达检测,采用TMB可以更好的预测患者能否从免疫治疗中获益。在TMB-L的人群中,可能有其他新的预测标志物,能够发现从免疫治疗中潜在获益的患者。
1140PD- 通过分析肿瘤的体细胞突变来探寻可以预测免疫检查点抑制剂治疗超进展(HP)的标志物
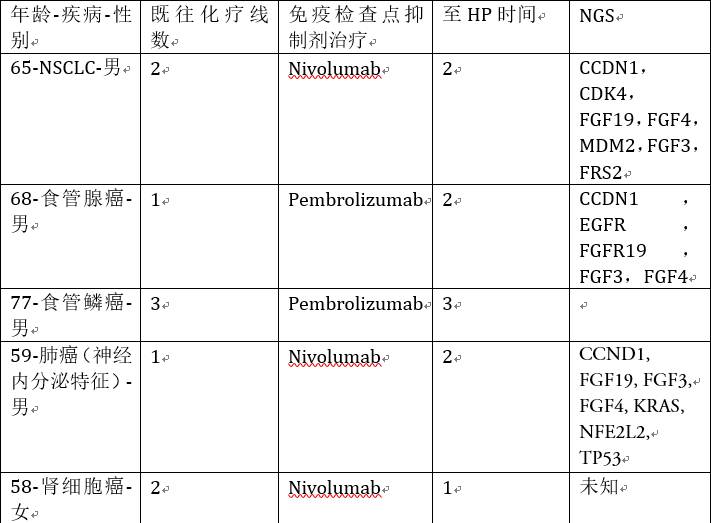
背景:既往已经报道了很多免疫检查点抑制剂治疗相关的假性进展。HP,定义为肿瘤反常的加速生长,目前在接受免疫检查点抑制剂治疗的患者中逐渐被关注。既往的初步研究数据显示,对免疫治疗前的肿瘤组织进行NGS检测,发现MDM2/MDM4的扩增可能是HP的潜在预测标志物。本研究旨在发现我们中心中发生HP的患者,探索患者体细胞突变的发生情况,并估计SA和HP发生的相关性。
方法:HP定义为:1. 在免疫检查点抑制剂治疗后第一次评价时进展;2. 肿瘤体积增加>50%;3. 肿瘤增长速度增加>2倍。通过整合我们中心的电子病例系统和分子检测数据库进行分析。采用FMI的NGS检测治疗前的肿瘤标本:首先提取DNA,采用杂交捕获的方法进行NGS检测,平均测序深度为>600,检测肿瘤相关的315个基因和常见肿瘤重排基因的47个内含子。
结果:5例患者评价为HP,4例(80%)患者的NGS结果可知。最常见的体细胞突变为MDM2/MDM4扩增(50%),EGFR扩增(25%)和委员染色体11q13-CCND1,FGF3,FGF4和FGF19(75%)的一些基因扩增。通过分析本中心的分子检测数据库(N=696),结果显示MDM2/MDM4,EGFR和11q13扩增的患者分别为26例(4%),26例(4%)和256例(4%)。在70例合并有这些基因变异的患者中,10例接受了免疫检查点抑制剂治疗,其中,MDM2/MDM4,EGFR和11q3扩增的患者,发生HP的患者各有2例(66%),1例(50%)和3例(43%)。患者的详细临床特征总结如下。
结论:有一部分接受免疫检查点抑制剂治疗的患者会发生HP。MDM2/MDM4,EGFR和位于11q13位点的一些基因扩增于HP发生相关。这些基因变异被热舞可能是预测HP的标志物,需要在更大样本量的患者队列中进行验证。免疫逃逸,免疫编辑,可能导致HP的原因有待进一步的机制探索;前瞻性的发现可能会出现HP的患者是非常有必要的,需要后续进一步的研究探索。
1141PD-第一个口服小分子靶向PD-L1和VISTA的双靶点小分子抑制剂CA-170,在临床前模型中显示出抑制肿瘤生长效应,在I其研究中观察到促进T细胞激活的作用
背景:PD-1和VISTA是独立的免疫检查点,抑制T细胞功能。临床前研究显示,双重阻断这些检查点,有协同效应。CA-170是一个靶向PD-L1和VISTA的双靶点口服小分子抑制剂,目前正在进行I期研究。
方法:在体外,采用人体,猴或老鼠的细胞分别进行了CA-170对PD-L1的抑制剂作用,或VISTA介导的T细胞功能抑制。体内试验,在同系的老鼠模型中检验了其抗肿瘤活性。研究入组了晚期实体瘤或淋巴瘤的患者,年龄>=18岁,ECOG PS评分<=1分,器官功能正常,在Ia期临床中接受剂量递增的CA-170每日口服治疗。Ib期剂量扩增队列中,计划筛选入组患者,纳入可能对这一药物有效的优势人群。主要研究终点包括:安全性,最大耐受剂量,和探索II期研究推荐剂量。次要研究终点包括:药代动力学和抗肿瘤活性。探索性终点包括:外周和肿瘤组织的标志物及药效学分析。
结果:体外实验显示,CA-170可以修复效应T细胞的功能,活性与PD-1或VISTA抑制剂效果相当。CA-170口服抑制剂可以抑制同基因组小鼠移植瘤肿瘤的生长(B16黑色素瘤,CT26和MC38结直肠癌),增强外周T细胞的激活,并促进肿瘤组织内浸润CD8+T细胞的活化。人体研究中,共19例患者接受治疗,6个不同的剂量组(50-800mg),并未观察到剂量限制性毒性。CA-170的血浆浓度随剂量递增成比例增加,T1/2为4-9.5小时。在口服CA-170治疗后,外周T细胞的激活表现在外周血循环CD8+T细胞的比例增加,和CD4+T细胞表达激活标志物。
结论:第一个口服小分子免疫检查点抑制剂CA-170的临床前研究和初步临床研究结果,显示出较好的前景,值得进一步研究。目前正在进行剂量爬坡研究。
1142PD-抗OX40的单抗PF-04518600(FP-8600)联合抗4-1BB单抗Utomilumab的I期剂量爬坡研究,评价该方案的安全性,药代动力学和药效动力学
背景:PF-8600和Utomilumab是全长人源化的IgG2单抗,靶向肿瘤坏死因子受体超家族受体OX40和4-1BB。通常而言,OX40主要影响CD4 T细胞功能,4-1BB主要影响CD8 T细胞功能。在临床前模型中显示,同时应用靶向OX40和4-1BB的抑制剂有协同效应,可以诱导CD8+和CD4+细胞毒性T细胞的克隆表达。既往的I期研究,评估了PF-8600单药联合utomilumab,与utomilumab单药类似,PF-8600单药在所有剂量水平的耐受性都很好,这为两药联合提高了理论基础。
方法:研究入组了不同瘤种的患者,包括NSCLC,头颈部鳞癌,黑色素瘤,膀胱癌,胃癌或宫颈癌的患者,这些患者都是目前标准治疗耐药后没有有效治疗方案的患者。患者接受PF-8600的治疗,剂量为0.1mg/kg到3mg/kg,联合utomilumab 20mg或100mg,q4w,静脉使用。采集患者的外周血标本进行药代动力学和药效果=动力学的分析。
结果:本次分析的截至时间为2017年1月30日(目前研究仍在进行),入组了28例患者,完成了既定5个研究剂量中的4个。没有观察到药物相关的死亡,剂量限制性毒性,或可以的不可预料的严重不良事件。所有药物相关的不良事件均为1-2度。最常见的AE包括恶心(10.7%),食欲下降(7.1%),乏力(7.1%)。所有的严重不良事件发生情况如下:3度AE 9例(32.1%)、4度AE 3例(10.7%)、5度AE 2例(7.1%,5度AE发生在最低剂量组)。研究发现,联合治疗相比于单用PF-8600,可以更显著的上调CD8+记忆T细胞的激活和增殖标志物的表达,也可以增加所有记忆T细胞亚群的活化标志物表达。在会上将会呈现初步的药代动力学和疗效数据。
结论:截止目前,PF-8600和utomilumab剂量爬坡的联合治疗方案并没有观察到预期以外的毒性。对剂量爬坡研究的安全性,疗效,PK,PD的分析,将有助于确定最佳的生物剂量用于后续的扩展队列研究。
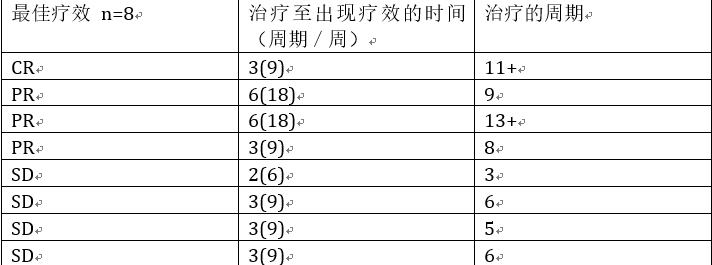
1143PD-探寻niraparib联合pembrolizumab用于转移性三阴性乳腺癌或复发性铂类耐药的上皮性卵巢癌的最佳联合剂量(TOPACIO/Keynote-162研究)
背景:铂类耐药的卵巢癌患者,后续缺乏有效的治疗方案,mPFS为3.5-6个约。Niraparib是一个口服的PARP1/2抑制剂(PAROi),可以显著延长既往对铂类有反应的复发性卵巢癌患者的PFS。临床前研究显示,PARPis联合PD-1抑制剂用于卵巢癌和TNBC有协同效应。在此,我们报道niraparib联合pembrolizumab方案I期研究的结果,并探寻推荐的II期研究剂量。
方法:本研究采用6+6的剂量爬坡设计,主要的终点在于评估剂量限制性毒性和确定II期研究剂量。入组了转移性TNBC患者,既往接受过<=4线的化疗或铂类耐药的卵巢癌,既往接受过<=5线的化疗,要求卵巢癌患者对一些含铂方案治疗敏感,CR或PR,PFS>6个月。
结果:研究入组了14例患者(年龄>=18岁),接受Pembro 200mg iv,第1天和niraparib 200mg(剂量水平[DL]1, N=7;2个TNBC,5个OC)或300mg([DL]2, N=7;3个TNBC,4个OC),口服,第1-21天,21天为1个周期。在DL1中,有1个患者出现DLTs(粒细胞减少,贫血和血小板减少),因此停止了niraparib治疗,但继续pembro治疗。在DL2中,有1个患者出现DLT,1个患者出现登机的DLT(都为血小板减少);所有的患者都降低剂量改为niraparib 200mg,并继续pembro治疗。最后推荐的II期研究剂量为niraparib 200mg po,qd+pembro 200mg iv,第1天(21天为1个周期)。根据RECIST 1.1标准,8例可评估疗效的OC患者中,4例出现相应;另外4个患者疗效评价为SD(见下表)。5例BRCA野生型的患者,1例接受了10个周期的治疗,疗效为SD。会上将会详细接受BRCA和PD-L1状态与疗效的关系。
表. 8例卵巢癌患者的疗效和治疗情况
+表示研究仍在进行;每3周进行1次疗效评价。
结论:本研究确立了II期研究的推荐剂量,在既往多线治疗后的TNBC或铂类耐药的OC患者中,初步显示了niraparib+pembro联合方案的治疗疗效。并没有观察到这两个药物的毒性重叠。目前正在进行II期研究。
责任编辑:肿瘤资讯-宋小编
28个肿瘤相关临床试验招募患者
点击下方图片即可查看详情