转录因子通过结合特定的DNA结合基序帮助启动或关闭基因,它的突变或失调可以导致基因表达程序异常,从而诱发疾病。现在有大量文献表明,靶向异常转录因子是一种有前途的治疗策略。人们曾多次尝试抑制转录因子的活性,但其显著的结构异质性以及缺乏激酶或其他酶中经常存在的易处理的活性位点,使得转录因子成为一个有希望但具有挑战性的治疗靶点(图1)[1]。
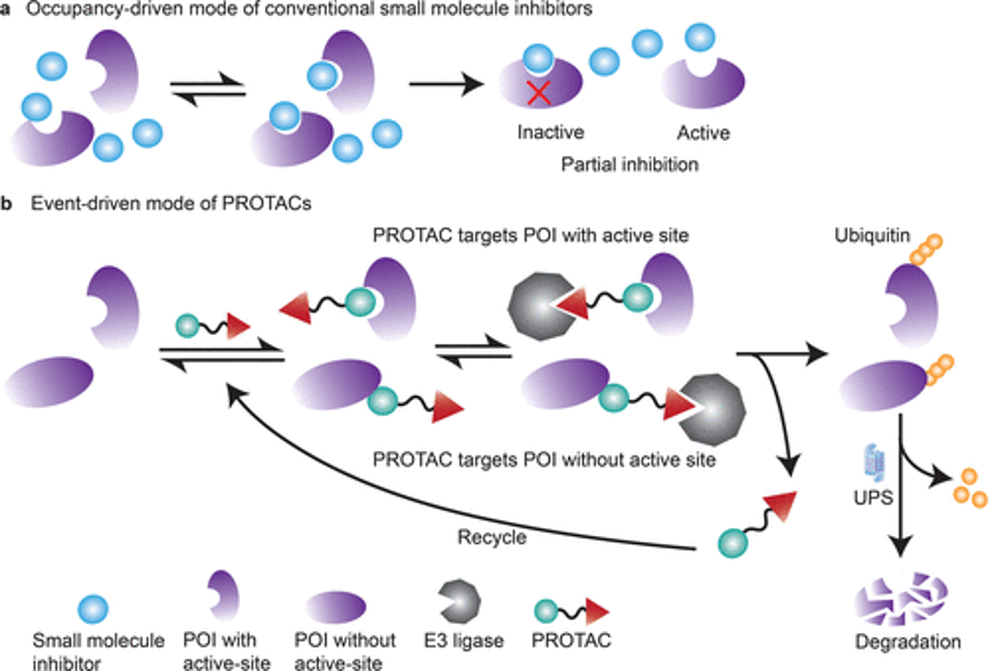
图1 PROTACS:机制和优势********[1]************
PROTACs是一种异双功能分子,含有一个与靶蛋白结合的配体和一个E3泛素连接酶的共价连接配体,通过泛素蛋白酶体系统降解蛋白质靶标。事件驱动的行动模式使PROTAC具有直接使目标蛋白降解的优势,而不是像传统的小分子抑制剂(SMI)依赖靶标的活性位点。由于其催化作用模式,PROTAC可以在低剂量下获得高效率,并与剩余的靶点再次结合(图2)。
图2 PROTAC优势概述********[1]************小分子PROTAC靶向转录因子的研究
鉴于靶向AR和ER的治疗价值,人们已将重点放在开发有效抑制其活性的拮抗剂或选择性调节剂上。但是内在和获得性耐药性的发展限制了它们的应用,研究人员以这些小分子抑制剂作为转录因子结合配体设计了一系列PROTAC解决这一问题。 例如以AR抑制剂为配体合成的AR降解剂ARV-110在AR野生型前列腺癌患者以及AR T878A和H875Y突变患者中显示出治疗效果。相反,这些突变人群对AR抑制剂苯扎鲁胺和阿比特龙具有耐药性[2];Wang的实验室通过优化以前的抑制STAT3 SH2结构域抑制剂CJ-887开发了一种细胞渗透性的STAT3降解剂等[3]。这些基于小分子的PROTAC具有更好的口服生物利用度、低毒性和优越的疗效,提供了比传统的转录活性抑制更好的治疗效果。到目前为止,几种针对转录因子的PROTAC正处于I期和II期临床试验,这确实令人满意。基于寡核苷酸的PROTACS
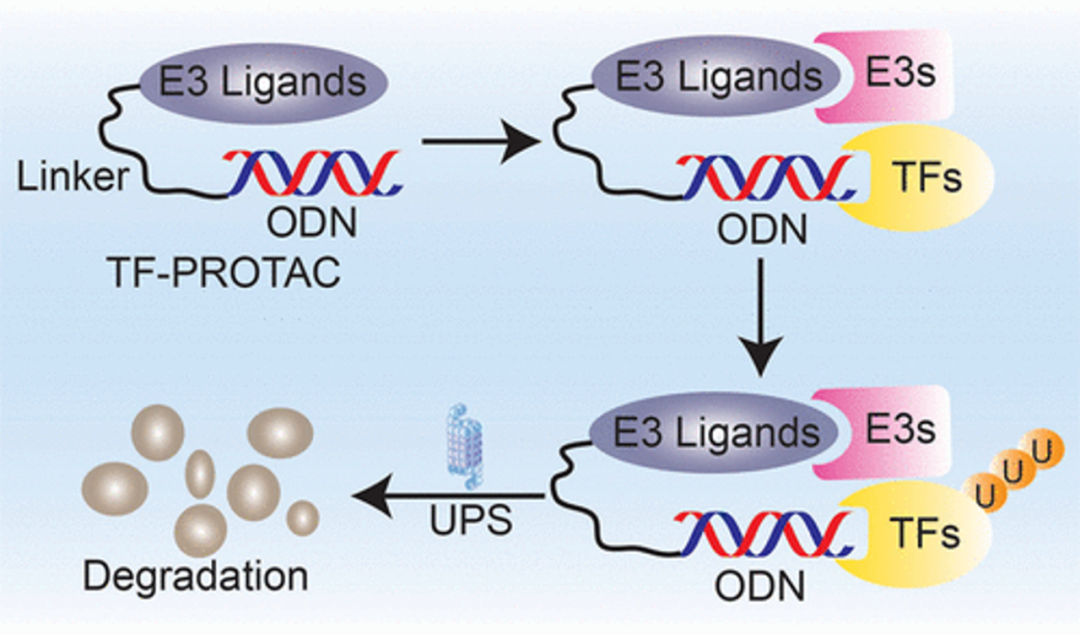
如上文所述,一些转录因子如AR和STAT3可以被SMI靶向,从而便于基于这些SMI开发PROTAC。然而,大多数转录因子仍然是无法成药或难以成药的。对此科学家们利用转录因子拥有特定的DNA结合基序的知识,使用这些寡核苷酸基序作为配体开发了一种可用于PROTAC靶向降解转录因子的策略。 例如,Wei实验室通过将DNA寡核苷酸(ODN)连接到E3连接酶配体,可以选择性地降解转录因子,称为TF-PROTAC(图3)。选择NF-κB作为靶点证明其原理。他们通过将叠氮修饰的NF-κB结合基序与双环辛炔修饰的VHL配体的无铜环化加成反应生成了TF-PROTAC。他们对接头的长度和极性进行了优化,最终发现两种基于VHL的TF-PROTAC,TF-κB-PROTAC(dNF-κB)和E2F-PROTAC(dE2F),它们能能够有效地降解细胞内内源性的NF-κB P65和E2F1蛋白,并在10~25μg/mL的浓度下显著抑制癌细胞的增殖和肿瘤形成[4]。Shao和他的同事开发了一种基于寡核苷酸的PROTAC(O’PROTAC),以靶向两个与癌症相关的转录因子,淋巴增强因子1(LEF1)和ETS相关基因(ERG)(图3)。针对LEF1,设计、合成和鉴定了6个基于CRBN和VHL E3连接酶配体的O’PROTAC。结果表明,LEF1的 O’PROTAC在体外能有效消除LEF1,在体内也能抑制前列腺癌细胞的生长。设计和合成了另一种O’PROTAC来破坏ERG,以评估O’PROTAC策略在降解其他转录因子方面的可行性。正如预测的那样,ERG O’PROTAC在体外降解ERG蛋白并抑制癌细胞的生长[5]。他们的发现,特别是体内疗效数据,揭示了O‘PROTAC的强劲降解和抗肿瘤效果,为O’PROTAC临床应用的开发奠定了坚实的基础。
图3 用于降解转录因子的基于寡核苷酸的TF-PROTAC********[1]************小结
由于寡核苷酸DNA是转录因子的天然配体,基于寡核苷酸的PROTAC具有通用性和灵活性,并且通过取代嵌合寡核苷酸的DNA部分,可以轻松地靶向其他转录因子,从而为靶向传统上不可药的转录因子铺平了道路。然而,它们的临床前和临床发展仍然会带来挑战。主要的挑战之一是递送,因为基于寡核苷酸的 PROTAC 总是带有大量负电荷。此外,欠佳的药物动力学和相对较低的效价可能会限制其未来的发展。相信未来随着技术的发展基于转录因子的PROTAC技术将走向成熟。
**参考文献 **
[1] Li Y, Song J, Zhou P, et al. Targeting Undruggable Transcription Factors with PROTACs: Advances and Perspectives. Journal of Medicinal Chemistry, 2022, 65(15): 10183-10194. [2] Proof-of-Concept with PROTACs in Prostate Cancer. Cancer Discov, 2020, 10 (8): 1084. [3] Bai L, Zhou H, Xu R, et al. A potent and selective small-molecule degrader of STAT3 achieves complete tumor regression in vivo. Cancer cell, 2019, 36(5): 498-511. e17. [4] Liu J, Chen H, Kaniskan H U, et al. TF-PROTACs enable targeted degradation of transcription factors. Journal of the American Chemical Society, 2021, 143(23): 8902-8910.
[5] Shao J, Yan Y, Ding D, et al. Destruction of DNA‐Binding Proteins by Programmable Oligonucleotide PROTAC (O'PROTAC): Effective Targeting of LEF1 and ERG. Advanced Science, 2021, 8(20): 2102555.
供稿:韩宇飞
校稿:赵振江/梅文义
编辑:王思雨****华东理工大学/上海市新药设计重点实验室/李洪林教授课题组▼招聘博后▼华东理工大学李洪林教授团队诚聘博士后
Li's Lab地址:上海市梅陇路130号 电话:021-64250213课题组网站:http://www.lilab-ecust.cn 长按扫码可关注