线粒体作为细胞新陈代谢活动中心,在调节细胞信号通路、呼吸循环、细胞凋亡方面发挥关键作用。正常细胞和癌细胞中的线粒体存在结构和功能差异,癌细胞线粒体除了能为细胞提供大量ATP外,还通过活性氧产生、钙离子转运及Bcl-2家族蛋白的调控等多种机制促进肿瘤的发展与转移,因此线粒体可视作肿瘤靶向治疗的潜在手段。目前已开发了多种基于小分子的靶向线粒体策略以用于癌症的诊断和治疗,包括传统化疗药物、用于光动力和光热治疗的光敏剂及联合疗法等。线粒体靶向单元
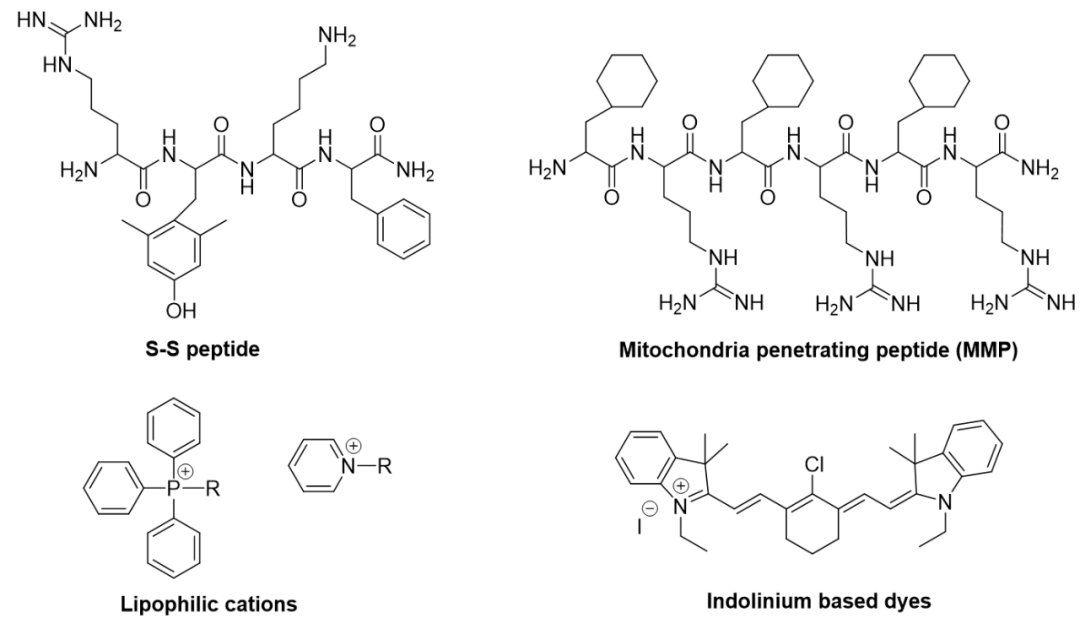
线粒体具有多孔外膜和富含蛋白质的内膜双层膜结构,与正常细胞线粒体(-157 mV)相比,超极化的癌性线粒体(-220 mV)利于被带正电荷的药物特异性地靶向和穿透。三苯基鏻离子(TPP)由于具有正电荷和疏水性质,是最常用的线粒体靶向基团。其他靶向剂如Szeto-Schiller肽、线粒体穿透肽(MPP)有助于肽标记的组分穿过质膜并有效地定位到线粒体中。基于小分子的线粒体靶向单元包括罗丹明、花菁和吡啶鎓离子等。
图1** 线粒体靶向单元的化学结构******[1]****靶向线粒体的光动力治疗
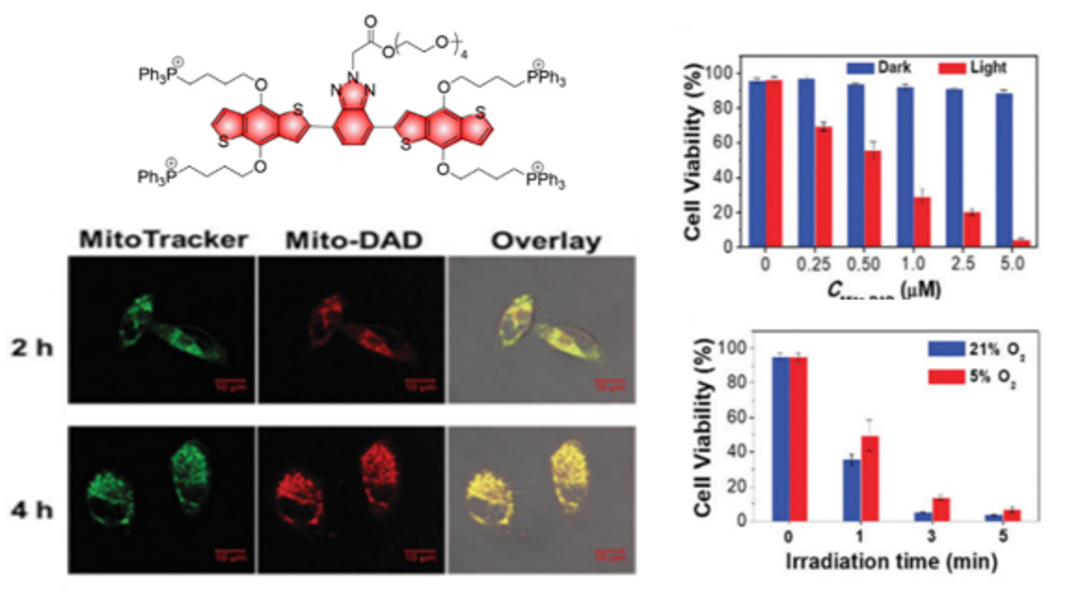
光动力疗法(PDT)作为一种微创型治疗方法,需要光敏剂、合适波长的光及氧气三组分同时参与。光敏剂在氧气的参与下经光照射后产生活性氧从而杀死癌细胞。由于PDT依赖于光激发且局限于照射部位,因此与常规化疗药物相比,PDT的副作用更小。 F.Fen报道了一种水溶性供体-受体-供体型双光子光敏剂Mito-DAD。其与四个TPP单元连接用于靶向线粒体。光照激活Mito-DAD后,HeLa细胞活力大幅下降,在缺氧条件下也观察到类似结果。水溶性低聚乙二醇(OEG)链的存在、强双光子吸收和高荧光量子产率使Mito-DAD成为具有优良PDT效果和NIR成像能力的光敏剂。
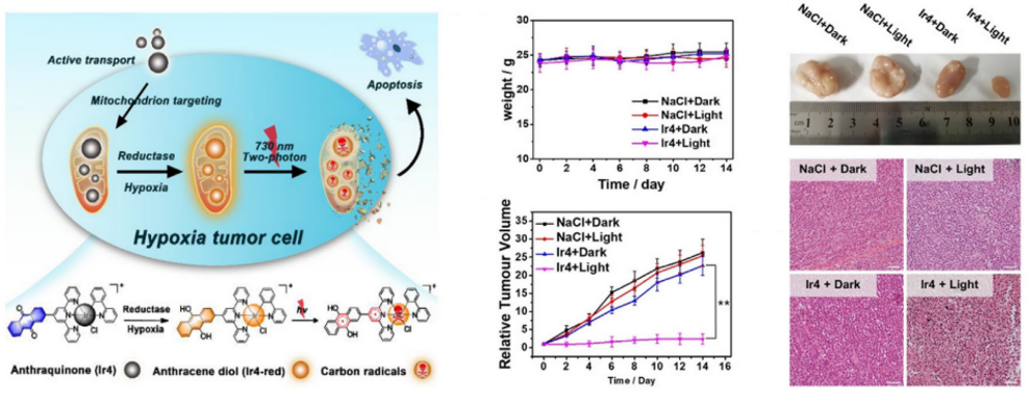
图2** Mito-DAD线粒体定位实验及有无光激活/常氧缺氧条件下对Hela细胞的抑制作用******[1]****金属配合物具有更有效的自旋轨道耦合,三重态通常更易获得且寿命更长,因此是光敏剂的理想单元,研究最多的是基于过渡金属Ru(II)和Ir(III)配合物的光敏剂。H.Chao报道了缺氧激活的Ir(III)络合物Ir4用于治疗缺氧肿瘤。Ir4在光照射下产生碳自由基作为细胞毒性物质而非单线态氧,因此即使在肿瘤的缺氧区域也可以实现有效的PDT。蒽醌猝灭剂的存在使它显示出弱荧光,在低氧条件下被还原为蒽二醇后荧光增强。随后在375 nm处照射还原后的络合物,产生碳自由基以发挥治疗效果,在小鼠A516荷瘤异种移植模型中,经光照肿瘤体积和重量均大幅下降。
图3 Ir4的抑癌机制及对A516荷瘤小鼠的肿瘤抑制效果****[1]****靶向线粒体的光热治疗
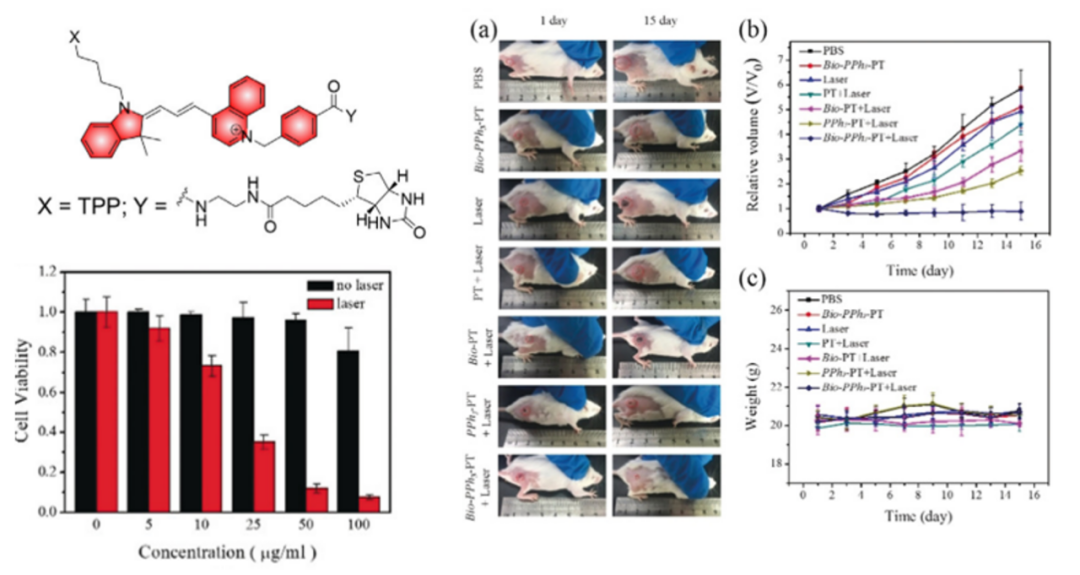
线粒体对热敏感,因此光热治疗(PTT)在靶向线粒体的癌症治疗中显示出应用前景。PTT指光热剂存在下将光能转化成热能从而杀死肿瘤细胞,相比于PDT,它不依赖活性氧的毒性从而减小了副作用。 B.Tang等开发了一种受花菁染料启发的新型治疗诊断剂Bio-PPh3-PT,可以靶向癌细胞(通过生物素)和线粒体(通过TPP基团)。在632 nm激光照射下,显示出浓度和激光功率依赖的良好光热转换效率(34.8%)。Bio-PPh3-PT的光疗效果在基于4T-1肿瘤细胞的体外和体内模型中得到进一步证明。
图4** Bio-PPh3-PT对4T1细胞及对4T1荷瘤小鼠的肿瘤抑制效果******[1]****靶向线粒体的化疗药物
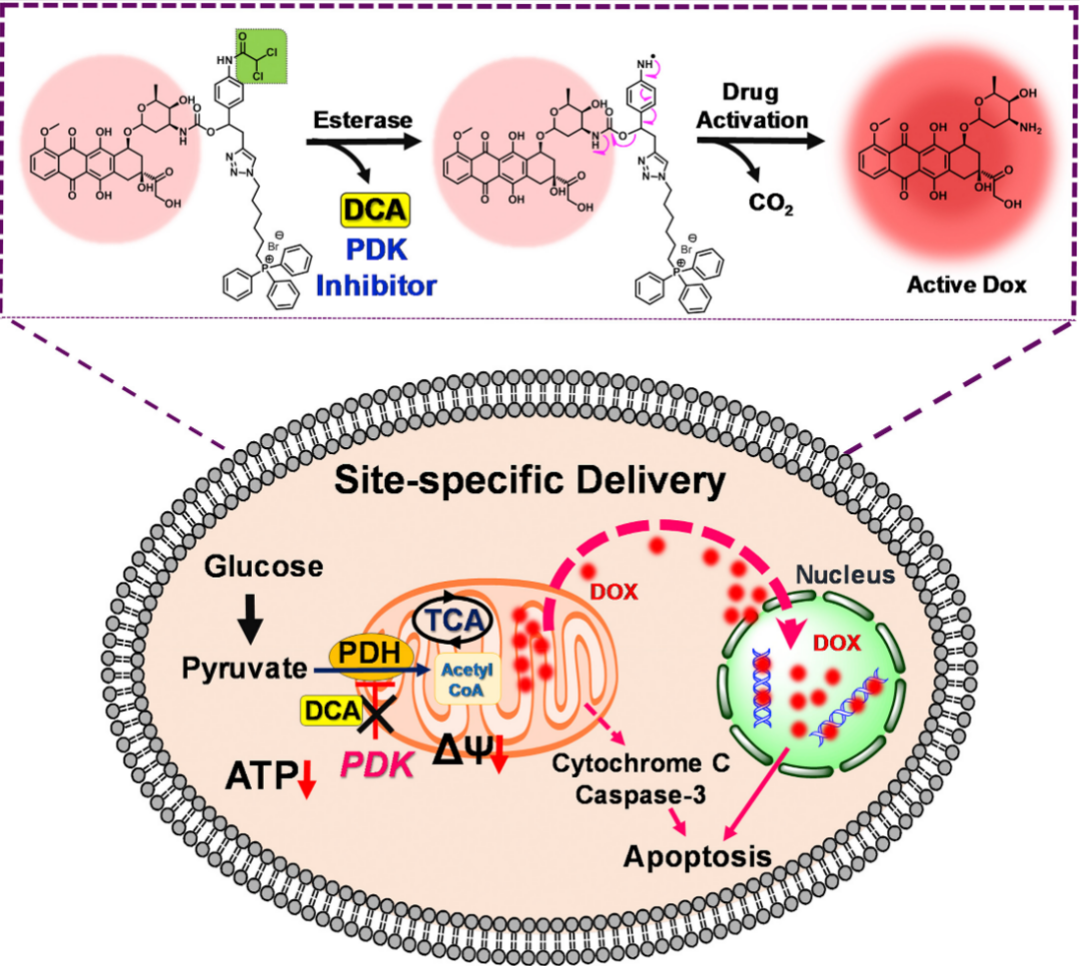
化疗药物和分子靶向治疗的耐药性是癌症治疗的挑战。其中抗癌药物阿霉素(DOX)易受到各种药物转运蛋白介导的药物外排影响而产生耐药。Sharma等开发了由二氯乙酸通过自牺牲接头连接到DOX上组成的靶向药物缀合物C1,TPP的引入以靶向癌性线粒体。前药可以被癌细胞中过表达的酯酶激活,规避了耐药相关机制,随后在线粒体释放的药物转移至细胞核以发挥药效。
图5 DOX缀合物C1的结构及作用机制[1]****靶向线粒体的联合疗法
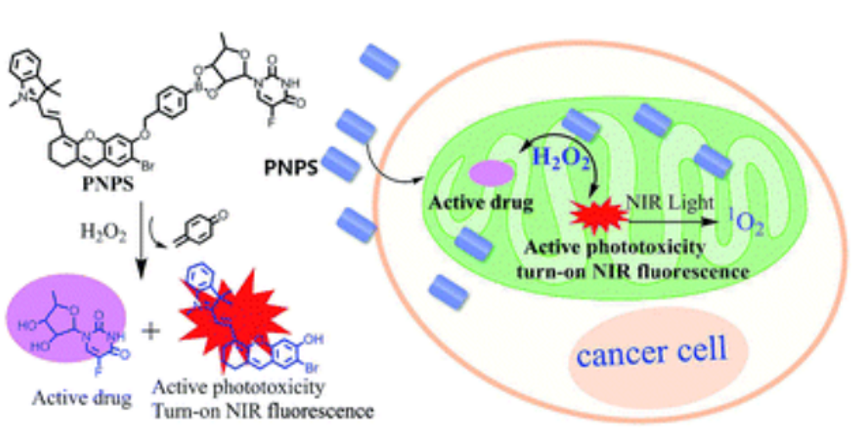
Tan等人开发了一种联合化疗和PDT靶向癌细胞线粒体的治疗方法。PNPS由线粒体靶向单元季铵盐和化疗药物5´-DFUR通过硼酸单元连接而成。在H2O2存在下,硼酸基团被破坏,释放出NPS和5´-DFUR分别用于近红外光动力治疗和化疗。同时,NPS还可以提供近红外荧光信号来监测激活药物的释放。基于其线粒体靶向能力,PNPS表现出比5´-DFUR更强的化疗效率。
图6** PNPS结构及抑癌机制**[1]****
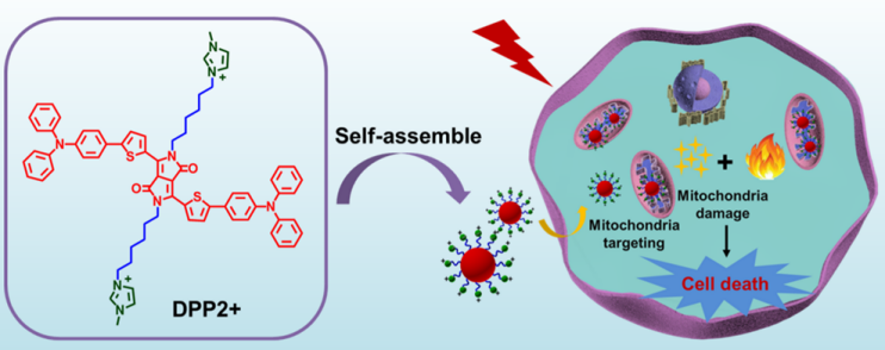
由于ROS和热量均能对线粒体损伤作用,因此可将二者联用以克服独立限制并提高治疗效果。Xie开发了一种亲脂性供体-受体-供体治疗诊断剂DPP2+,在635 nm激光照射下能产生热能和单重态氧,具有理想的细胞相容性并靶向线粒体。在体外和体内抗肿瘤实验中,DPP2+纳米粒表现出良好的抗肿瘤作用。
图7** DPP2+结构及抑癌机制**[1]************小结
与传统策略相比,光疗法有助于克服获得性耐药并降低所需治疗剂量,结合肿瘤部位其他特征有潜力用于特异性前药激活。但是正电性的线粒体靶向单元可能会限制其在体内的适用性,如与带负电荷的蛋白质和酶相互作用等,产生聚集并降低靶向能力。因此,需开发中性基团或两亲性肽作为新型线粒体靶向单元。同时结合纳米自组装系统有助于改善药物清除速度过快等问题。
**参考文献 **
[1]Singh H, Sareen D, George J M, et al. Mitochondria targeted fluorogenic theranostic agents for cancer therapy. Coordination Chemistry Reviews, 2022, 452: 214283.
供稿:王凤至
校稿:赵振江/梅文义编辑:王思雨华东理工大学/上海市新药设计重点实验室/李洪林教授课题组▼招聘博后▼华东理工大学李洪林教授团队诚聘博士后