Nature子刊综述|疾病建模和药物控制中的计算系统生物学
基于Omics的方法在确定疾病机制和药物应答方面的影响越来越大。考虑到疾病和药物应答在相关的组学数据交互中是共同表达和调节的,传统的从单个孤立获取组学数据的方法不能总是获得有价值的推断。此外,药物有可能给患者带来副作用,而且针对疾病推出新药的成本很高。
为了解决上述困难,系统生物学通过整合基因组、蛋白质组、转录和代谢层的组学数据来预测潜在的分子相互作用。
结合已知的药物应答,由此产生的模型通过药物重利用并结合药物分子提高药物的治疗性能,而不会产生非靶向效应。基于确定的计算模型,药物管理控制旨在平衡毒性和疗效。
近日,nature systems biology and applications期刊发表了题为"Computations systems biology in diesease modeling and control, review and prespecitives"的综述文章。
介绍了基因、蛋白质和药物分子之间相互作用的生物医学应用和分析,以模拟疾病机制和药物应答。通过将预测和计算模型与控制规则(control laws)设计的药物管理相结合,以提高治疗性能。
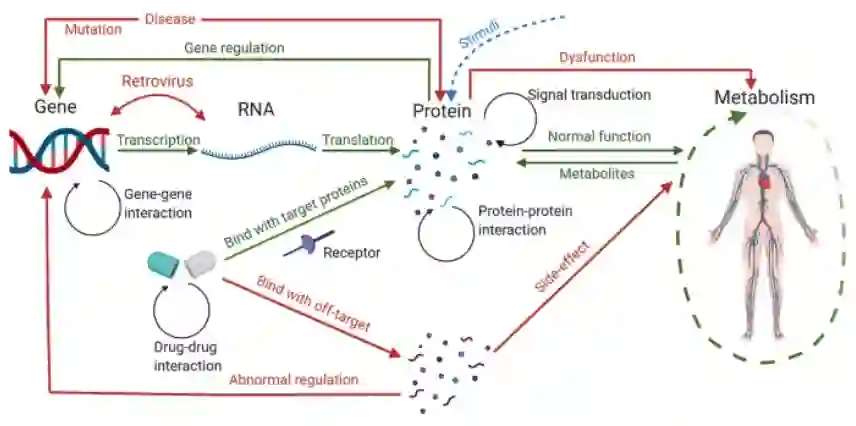
基因组、蛋白质组和转录组水平之间的相互作用揭示了生物体内的调节过程。药物分子通过与特定靶配体结合来干预这一过程。为了研究整个疾病机制和药物应答,需要同时分析这些组学数据和化学分子。
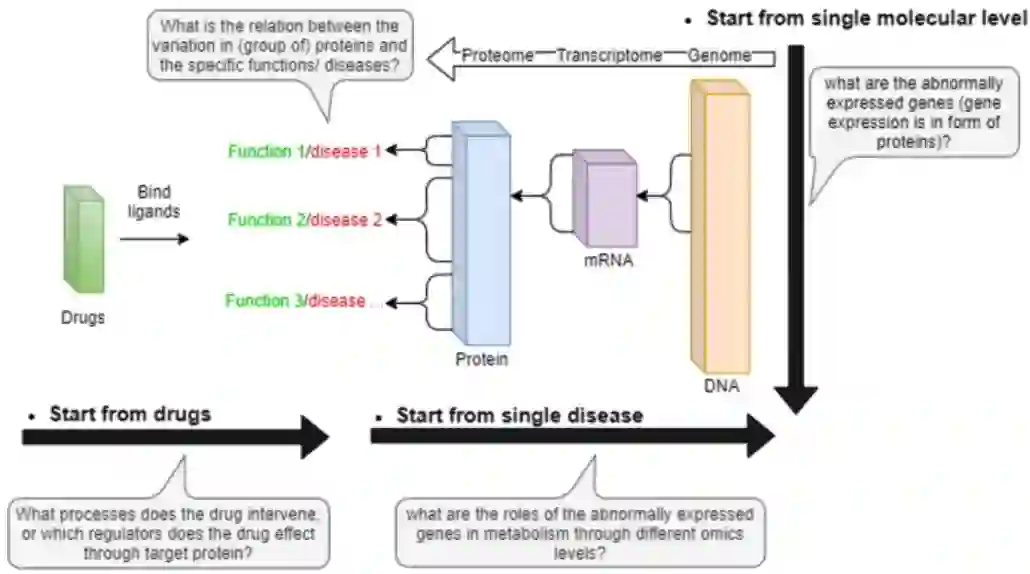
系统视图使科学家能够通过多层数据集成从更高层次建立疾病模型。通过单层垂直分析,通过异常基因表达值识别疾病相关分子。通过不同层次的横向分析,交互信息用于跟踪疾病或药物在整个生物过程中的作用。
利用多层组学数据,可以同时在不同的临床模式中研究单个疾病(即上图中的水平方向),也可以从单个模式中探索不同的疾病(即,图2中的垂直方向)。
系统方法使化学分子和生物分子更有可能与表型联系起来,用于分析疾病和药物,并确定它们之间的潜在关联。
通过不同层次的调控对疾病通路和药物应答进行建模,有助于基于已知分子相互作用的药物重定位和药物组合。
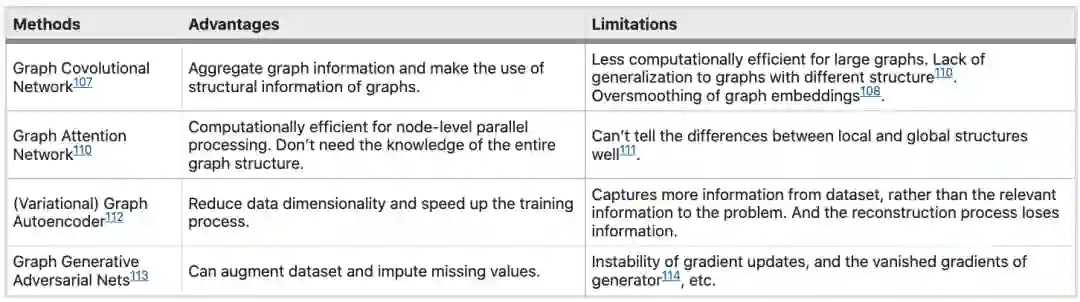
本论文将基因、蛋白质和药物分子之间的相互作用模型分为两大类:静态网络模型和动态模型。这两个框架都整合了生物信息。该模型用于研究疾病机制和药物应答。这两个主要任务包括(1)从疾病机制和药物应答中获得潜在的分子相互作用,以及(2)药物剂量管理。
疾病和药物的静态网络
组学数据的相互作用
由于表达关系,基因和蛋白质总是一起进行分析,以便对复杂疾病进行遗传分析。对于全基因组关联,蛋白质和基因相互作用可以识别人类蛋白质相互作用中紧密相连的模块。
蛋白质相互作用网络将蛋白质(节点)及其相互作用(边)的信息编码到网络结构中。PPI网络有助于预测潜在的疾病相关蛋白,其假设是疾病相关PPI网络中的共享成分可能会导致类似的疾病表型。
静态分子相互作用建模的目的是利用相互作用曲线找出潜在的相互作用对。建模从使用组学数据识别疾病相关调控子开始。考虑到疾病相关微阵列上的RNA测序数据是可用的。疾病相关基因可以从差异表达基因(DEG)中选择,该差异表达基因是基于修正的t统计分析和R语言中的Limma的经验Bayes。表达数据变化较大的基因可以根据倍数变化和p值进行选择,并且可以映射到PPI网络。Limma侧重于基因表达水平的统计意义,其效果受样本数的影响。
对于基于微阵列数据的基因共表达分析,经常使用皮尔逊相关系数(PCC)。注意PCC假设基因表达是线性相关的,这在生物学系统中可能不成立。
在用于识别跨物种相互作用的基因共表达网络中,基因对的互信息和Z scores是使用Context Likelihood of Relatedness algorithm,该算法用于推断网络中的边。该算法可以处理基因表达的非线性变化,与PCC相比,具有更高的精度。然而,仍然需要PCC来区分基因对相关性的(正或负)方向。
构建基因共表达网络的方法
最终,基于基因共表达网络中的基因簇获得目标蛋白。然后可以根据这些蛋白质预测可能干预疾病进展的药物。剩下的问题是如何检测与小基因表达变异相关的疾病机制。因为一些基因的微小变化可能对整个过程有重要的贡献。请注意,基因表达水平研究排除了非转录相互作用,这可能是预测分子相互作用的潜在的限制。
药物和靶点相互作用
DTI网络中的节点包括药物、药物靶点和非靶点蛋白质。为了预测药物副作用,可以根据药物临床相关性将非靶点联系起来。对于药物组合,不同的药物可能会产生相互作用,导致患者产生副作用或降低药物疗效。这需要我们识别潜在的药物-药物相互作用(DDI),通过药物的共享靶点扩大DDI来探索。丰富的DDI可识别潜在的靶点,并发现新的治疗用途,并具有惊人的疗效。此外,基于文本挖掘的分子相互作用在很大程度上依赖于现有报告和参考文献,线索不足会导致预测不准确。
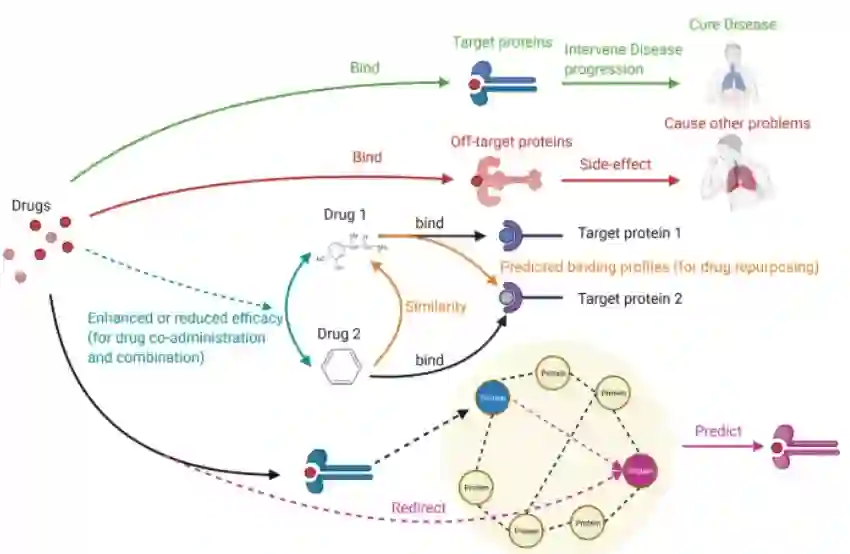
药物和靶蛋白之间的相互作用为药物组合、药物联用和药物重利用提供了机会
药物分子可能与诱导副作用的非靶蛋白结合(用红色箭头标记),这应该避免。尽管如此,治疗药物分子应该保留,因为它们可以根据需要发挥治疗疾病的作用(用绿色箭头标记)。药物之间的相互作用通过药物联用和药物co-administration(用青色箭头标记)提供了提高治疗效果的机会。药物-靶点相互作用传递的药物相似性为药物重利用提供了机会(用橙色箭头标记)。药物靶点可以通过蛋白质-蛋白质相互作用扩大到类似的蛋白质,用于药物再利用(用紫色箭头标记)。此图中的药物分子包括肾上腺素(Drug 1)和苯(Drug 2)
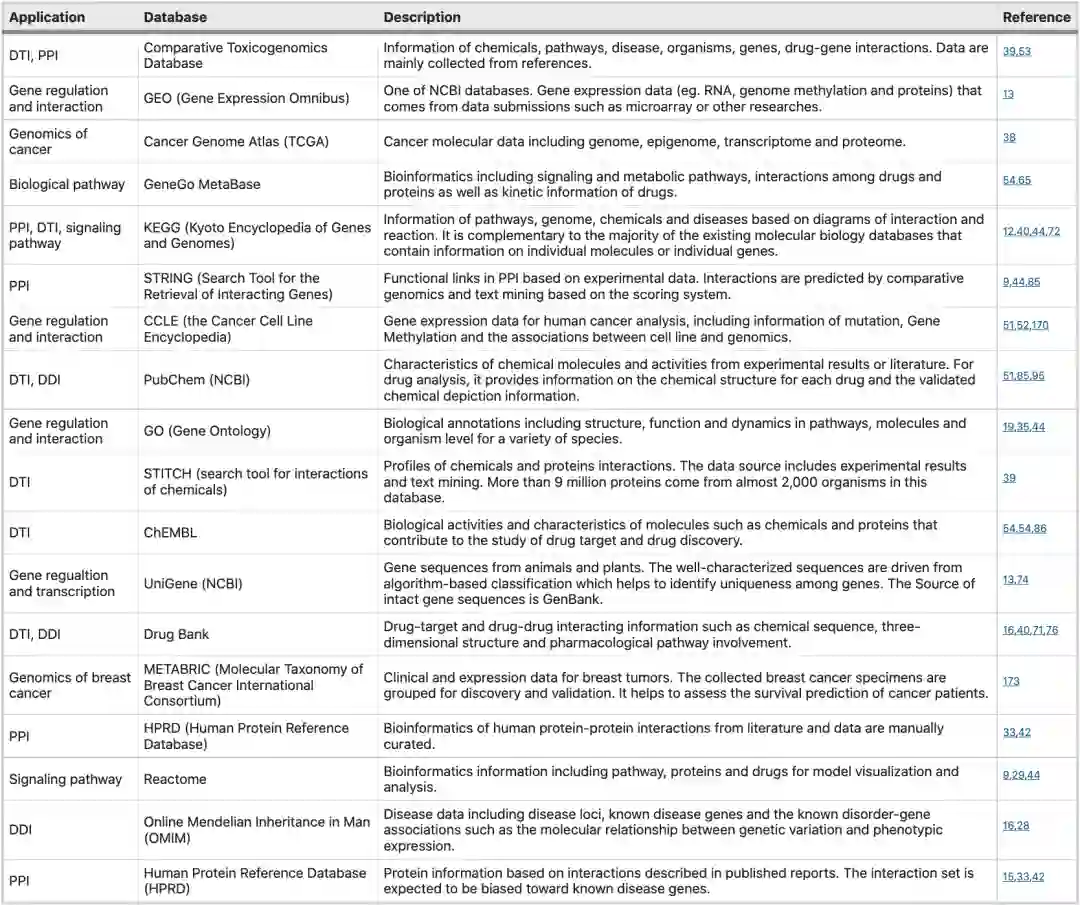
基因和蛋白质相互作用分析数据库如下:
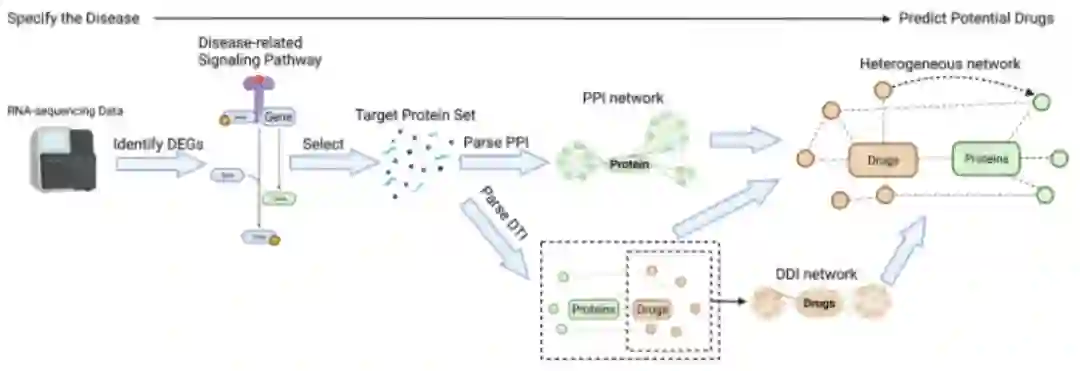
一个构建静态网络的案例
RNA测序数据中基因表达值的统计分析可识别差异表达基因DEGs
含有最高比例的DEG的信号通路被视为与疾病相关。这些通路中的全部或部分蛋白质被选择来形成靶点蛋白集。通过解析数据库中的PPI和DTI数据,构建了PPI网络和DTI网络。DTI网络中的药物分子也用于解析和构建DDI网络。最后,DTI连接DDI和PPI,从而构建异构网络。预测特定疾病的潜在药物的任务现在转为预测蛋白质和药物分子之间的相互作用。
静态建模分析
尽管疾病或药物的模型已经研究了几十年,但实际的生物系统远比完整的模型复杂,这表明探索更全面的模型的潜力。
重要性量化
网络中相互作用的重要性要求是可测量和排序,以降低网络复杂性并生成权重,这样简化的网络仅包含与疾病相关的分子,从而提高学习过程的效率。
拓扑描述符,如degree,betweenness, closeness经常用来量化网络中节点的重要性,并将空间信息嵌入建模。也可以基于统计进行重要性量化。例如Z-scores衡量观察结果的可变性。特征值可用于量化数据投影的重要性,例如使用“特征基因”量化基因共表达簇的重要性,以在建模时保留最重要的基因和模块。
相似性分析
相似性分析描述了静态网络中元素之间的相似性。假设相似的节点具有相似的交互谱。例如,相似的药物化学结构对疾病显示出相似的治疗效果。根据分子类型,可以使用不同类型的相似性。细胞系之间的相似可以使用基因表达谱的相似性获得。其它类型的相似性可以是药物表型副作用相似性、病理相似性等。
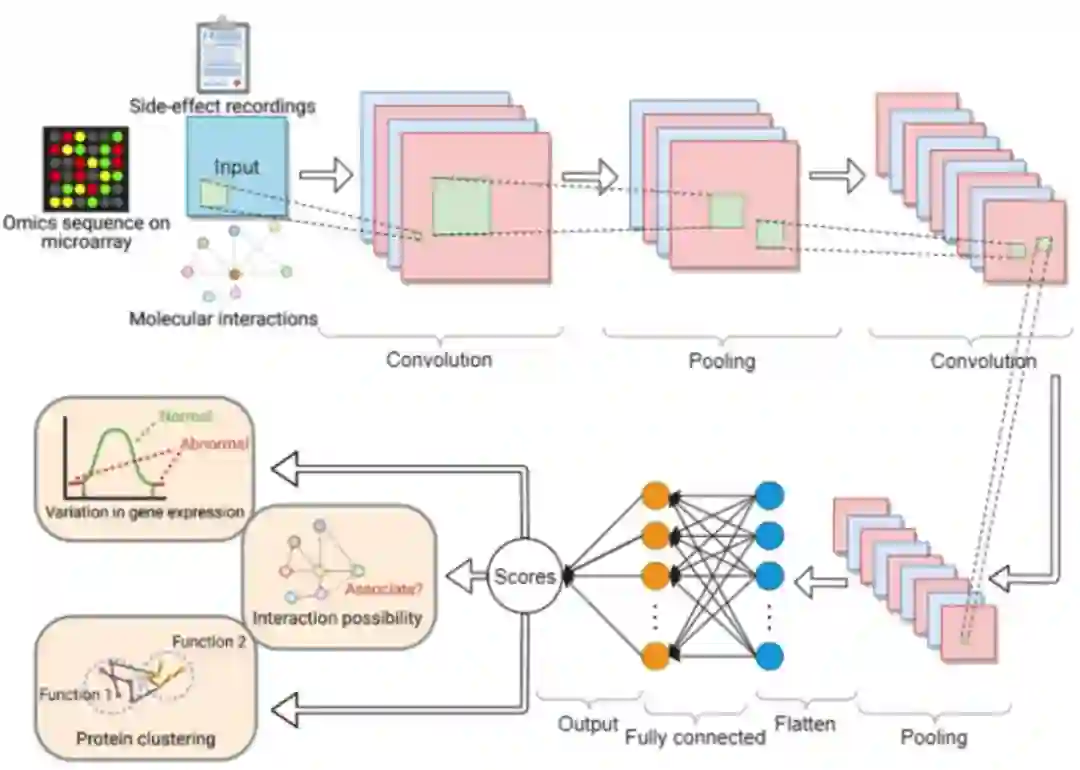
基于学习的聚类和分类方法
该神经网络输入是原始特征,比如分子序列模式、基因调控注释和模式、分子相互作用网络基序、分子结构和结构关联、药物化学结构、药物副作用报告等。输出可以是预测分类(例如分子结合谱)和回归(例如量化的分子结合亲和力)。
基于学习的方法用于预测分子相互作用
基于图的学习用于预测分子相互作用
综合静态建模通过网络传递信息,预测可能产生更全面的疾病模型。计算节点和边之间的相似性,并将量化信息嵌入到节点和边中。然后,可学习的模型寻找代表性特征来预测潜在的分子相互作用。
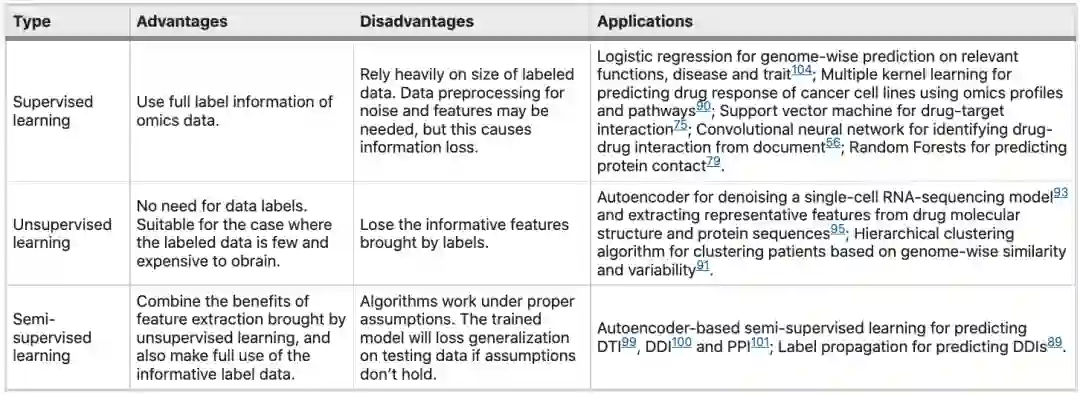
基于静态建模的疾病治疗预测的好处包括:(1) 预测的疾病相关调节因子可以作为新药靶点,通过为相同疾病寻找新药,潜在的提高治疗效果;(2)已知的药物靶蛋白通过PPI将药物分子重定向到与类似蛋白结合,以实现药物再利用;(3) 从预测模型中确定的蛋白质/基因可以解释患者特定疾病表型或特定药物应答的变异性,这有助于精准医疗;(4)预测的非靶点活动有助于避免副作用。(5)潜在的药物相互作用有助于通过药物组合设计新的治疗方法,因为药物组合可能降低或提高药物治疗效果。
生物调控的动态建模
动态疾病是指疾病的发病机制主要是由生物体新的动态行为的出现引起的,与潜在的发病机制无关。疾病的动态和药物应答可为治疗设计提供信息。动力学模型通过建模患者相互作用体的time-course行为来预测疾病结果。
基因调控网络
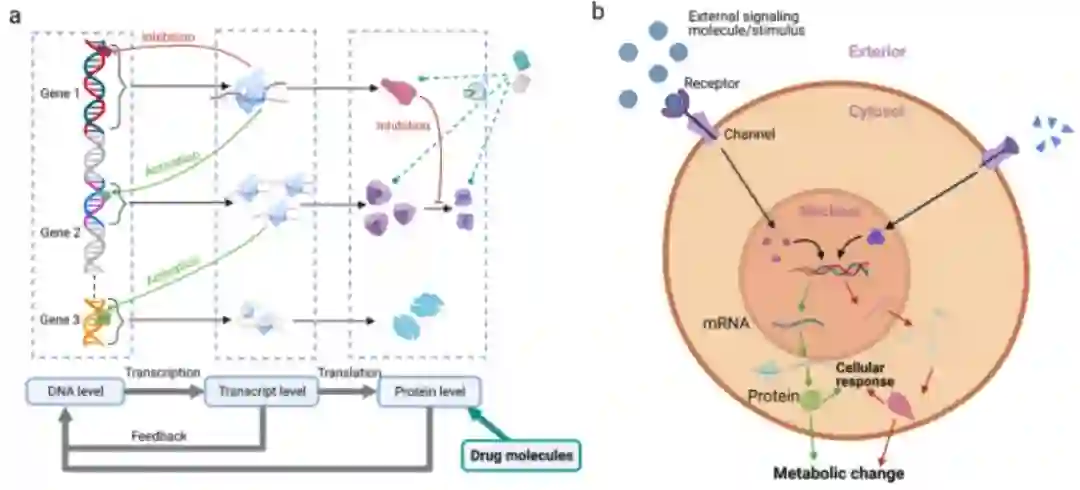
在生物体中,基因表达的变化导致表型的变化。基因通过RNA和蛋白质表达产物相互作用,从而控制网络中的基因转录到信使RNA的速率。
a. 基因调控网络。基因1、2和3是编码基因。基因1调节自身和基因2的表达。基因1产生的蛋白质通过信号因子/蛋白质(由基因2表达的蛋白质产生)调节基因3的表达。药物可以与改变基因表达的蛋白质结合来干预调节。b. 信号转导图。信号被接受并进去细胞核以改变基因表达。蛋白质被合成来调节细胞或组织的表型行为。信号通路中的错误(如,失调,失衡)可能导致细胞凋亡的停止,从而导致无限生长和分裂。
信号通路和转录
信号转导通路包含生物体内分子间的调节器。这归因于基因表达和基因连接的变化。信号转导的错误会导致生物体的发育改变和错误的行为决定,其功能障碍可能导致细胞生长失控或肿瘤发生。在蛋白水平上,信号通路由蛋白质相互作用组成,涵盖活细胞的生物学功能,它捕获了基因转录和蛋白质合成的内部和细胞内调节机制。动态信号通路的建模衡量疾病的进展。
转录因子(TFs)是建立基因调控关系模型的关键。例如,TF调节免疫系统固有细胞和适应性细胞的发育。动态转录和翻译子网络已被用于模拟细胞间和细胞内异质性调节的固有反应的触发机制。
分析动态模型
动态调节的数学模型
组学数据的动态反映了生物体内对内部环境因素变化的响应。即使大多数对应的基因相同,代谢和表型的变异也可能很大。动态建模应用数学工具量化不同条件和时间序列下基因调控的状态变化率。本论文回顾了使用微分方程(DEs)对疾病进行计算建模的情况,这些微分方程可用于控制理论的药物管理。
DE捕捉系统对疾病或药物引起的变化的反应。从系统的观点来看,DEs将来自多层组学数据的信息整合为一个统一的形式。DEs对生物题的动态行为进行建模。DEs还被用于量化通路中的信号流,并探索致癌突变对配体动力学的影响。
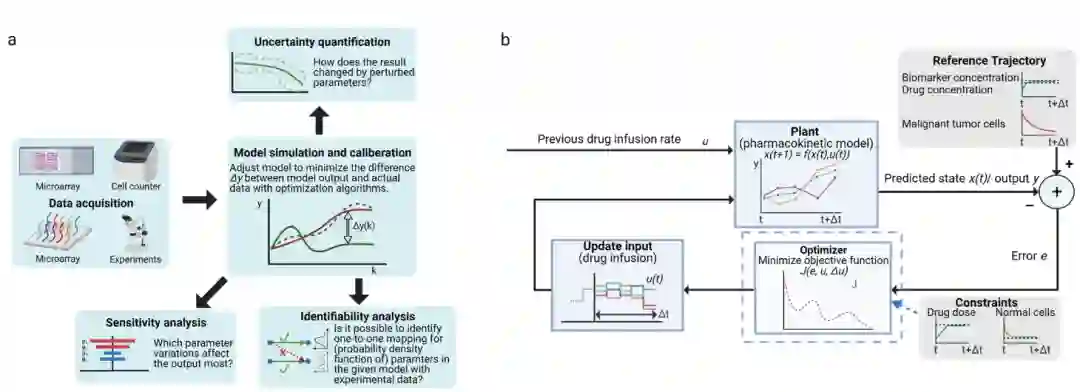
动态模型中的参数估计
a.参数估计方案。数据采集后,通过最小化实验数据和模型输出之间的差异,将参数拟合到模型中。敏感性分析、不确定性量化和可识别性分析有助于评估拟合的性能和稳健型。b.模型预测控制回路。基于模型预测的输出,该控制策略更新控制输入(例如,给药),使系统动力学在每个时间间隔内跟踪参考轨迹(例如,期望的肿瘤细胞减量)。其本质是处理约束优化问题(约束可以是最大药物剂量和最小正常细胞群)。
药物管理与控制理论
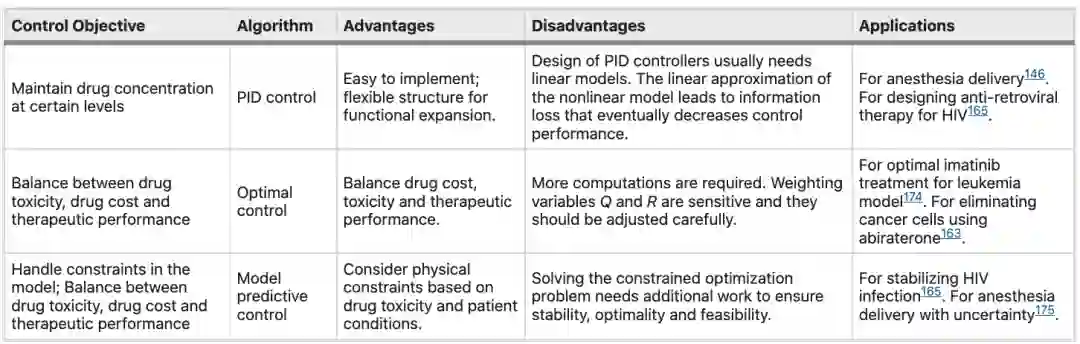
药物剂量是通过控制算法为患者的康复而设计的。虽然在现实世界中,药物在血浆中的浓度动力学和药物反应通常是非线性的,但由于复杂度降低,通常使用线性化模型来近似原始系统的非线性行为。
药物管理中的控制算法
讨论与展望
基于计算系统生物学的药物预测已显示出其在精准医学、药物组合和药物重利用方面的潜力。由分子相互作用组成的静态网络能够通过节点和边的传递信息,根据已知组学数据预测潜在的相互作用对。
分子相互作用图中的新参与者有助于更全面地了解疾病进展和药物应答。这使得具有更好治疗性能的药物分子,同时避免了靶外效应。此外,还可以确定潜在的患者特定的调节因子,以解释个性化治疗的个体差异。
然而,由于体内行为的变化,预测可能会是失败,这使得动态建模成为必要。动态建模旨在建立数学模型来预测疾病进展和药物应答。
从静态建模中确定的潜在参与者可以是动态模型中的新元素。通过应用控制算法设计的最佳药物剂量,可以有效干预疾病进展。静态模型和动态建模的结合使用使其成为疾病分析和治疗设计的强大工具。
通过基于DDI和PPI扩大药物和靶点来建立DTI模型,为(1)同一药物寻找新靶点,(2)为相同疾病探索新药物,以及(3)最小化安全治疗的非靶点副作用提供了机会。
结合应用控制理论改变患者病情的给药,可以同时实现治疗效果更好、损失更低的治疗。
专知便捷查看
便捷下载,请关注专知公众号(点击上方蓝色专知关注)
后台回复“CSPD” 就可以获取《Nature子刊综述|疾病建模和药物控制中的计算系统生物学》专知下载链接