【JAMA Oncology】AvaALL研究:贝伐珠单抗跨线治疗不能改善OS
既往在乳腺癌和转移性结直肠癌均探索了贝伐珠单抗跨线治疗。AvaALL研究是第一项随机III期研究评估NSCLC患者一线进展后,后续多线贝伐珠单抗治疗的疗效和安全性。近期,这一研究结果在JAMA Oncology杂志发布。
背景
回顾性分析提示在晚期NSCLC患者中,在诱导治疗后贝伐珠单抗持续治疗可以带来生存获益。随机II期WJOG 5910L研究显示,在非鳞NSCLC患者中,贝伐珠单抗跨线治疗可以带来显著的PFS获益和无统计学意义的生存获益。观察性研究ARIES提示,进展后继续贝伐珠单抗治疗可以延迟转移性结直肠癌的OS,这一结果在开放III期研究ML18147中得到确认。III期TANIA同样显示,在乳腺癌中,贝伐珠单抗联合化疗维持治疗对比单纯化疗维持治疗,可以改善PFS。开放表现的随机IIIB期研究AvaALL评估了在晚期NSCLC患者中贝伐珠单抗一线治疗进展后继续贝伐珠单抗维持治疗的疗效和安全性。
方法
AvaALL研究在晚期非鳞NSCLC患者中评估了第一次进展后,继续标准化疗联合或不联合贝伐珠单抗。患者在第一次进展后随机1:1分配接受研究者选择的二线标准治疗,联合或不联合贝伐珠单抗(7.5或15mg/kg,q21d)。在第二次和第三次进展后,接受贝伐珠单抗治疗的患者继续接受标准治疗联合贝伐珠单抗治疗,而标准治疗组仅接受标准治疗。超过三次进展后,对于未出现不可耐受毒性的患者,是否继续使用贝伐珠单抗由研究者决定。各线治疗时,贝伐珠单抗的剂量相同。主要研究终点为第一次激战后贝伐珠单抗维持治疗对比标准治疗的OS。次要研究终点包括第一次进展随机至第二次进展和第三次进展的PFS,分别为PFS2和PFS3;第一次进展随机至第二次进展和第三次进展的TTP,分别为TTP2和TTP3以及安全性。
研究的纳入标准包括:非鳞NSCLC,在接受一线贝伐珠单抗(4-6个周期)联合含铂双药化疗后,在第一次进展前至少接受了2个周期的贝伐珠单抗单药维持治疗;至少有1个可测量病灶;ECOG PS评分0-2分;允许无症状既往接受过局部治疗的脑转移患者入组。排除标准包括:非小细胞和小细胞混合癌或混合性腺鳞癌,以鳞癌成分为主;EGFR突变;随机近3个月内有2度或以上的咯血;肿瘤侵犯大血管;随机28天内接受过放疗。
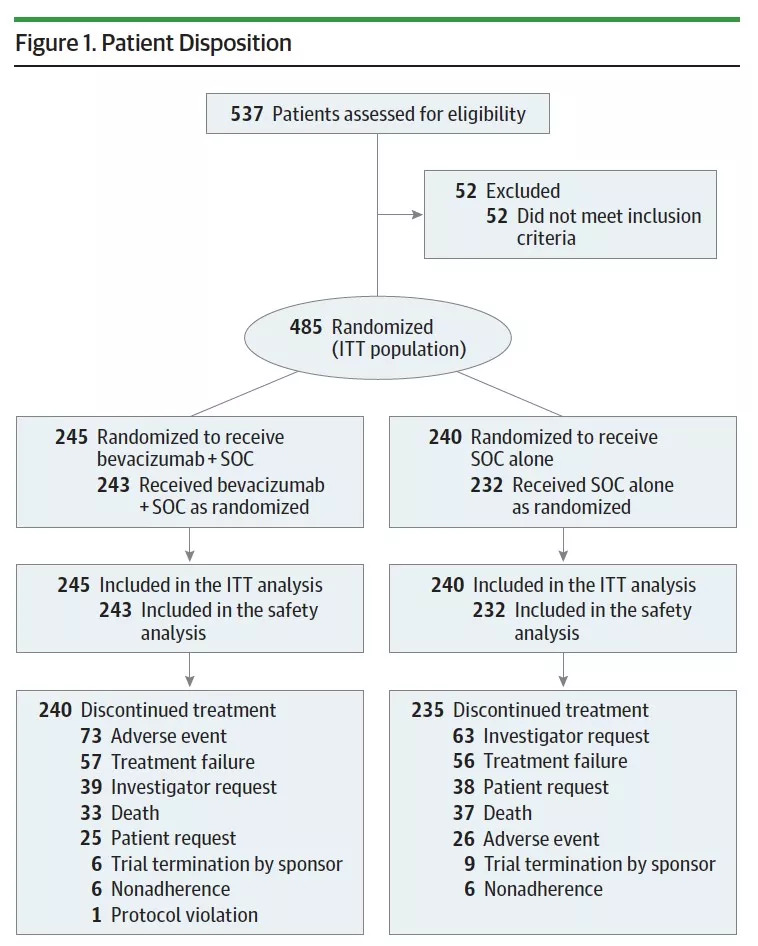
图1.研究入组流程图
结果
2011年6月至2015年1月,共485例患者参与随机,其中贝伐珠单抗组和标准治疗组分别为245例和240例;接受治疗的患者共475例,其中贝伐珠单抗组和标准治疗组分别为243例和232例,研究入组流程图见下图1,两组患者的基线特征均衡。
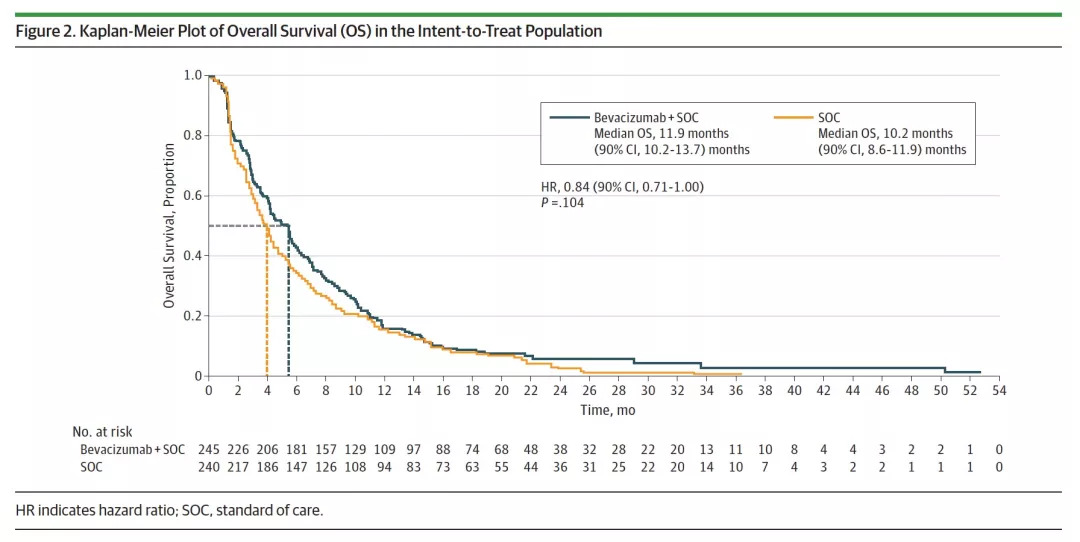
本次分析的截止日期为2016年6月24日,主要分析在第一个病人入组后60个月进行,共387例患者达到OS终点事件。结果显示,贝伐珠单抗组对比标准治疗组的OS在数值上更长,但无统计学差异,分别为11.9个月 vs 10.2个月,HR 0.84,P=0.104,见下图2. 亚组分析显示出相似的结果,除非吸烟人群和年龄75岁以上的患者。根据贝伐珠单抗的使用剂量进行分析,患者的中位OS也无显著性差异,贝伐珠单抗7.5mg/kg组的mOS与对照组对比为11.4 vs 10.2个月,HR 0.86;贝伐珠单抗15mg/kg组的mOS与对照组对比为12.6 vs 10.2个月,HR 0.84。
图2.意向性治疗人群,两组OS对比
mPFS2对比,贝伐珠单抗联合标准治疗组对比标准治疗组在数值上更长,但无统计学差异,分别为5.5 vs 4.0个月,HR 0.83;P=0.06;亚组分析显示出相似的结果,除ECOG PS2分或非吸烟者。mPFS3对比,贝伐珠单抗组对比标准治疗组显著更长,分别为4.0 vs 2.6个月,HR 0.63。
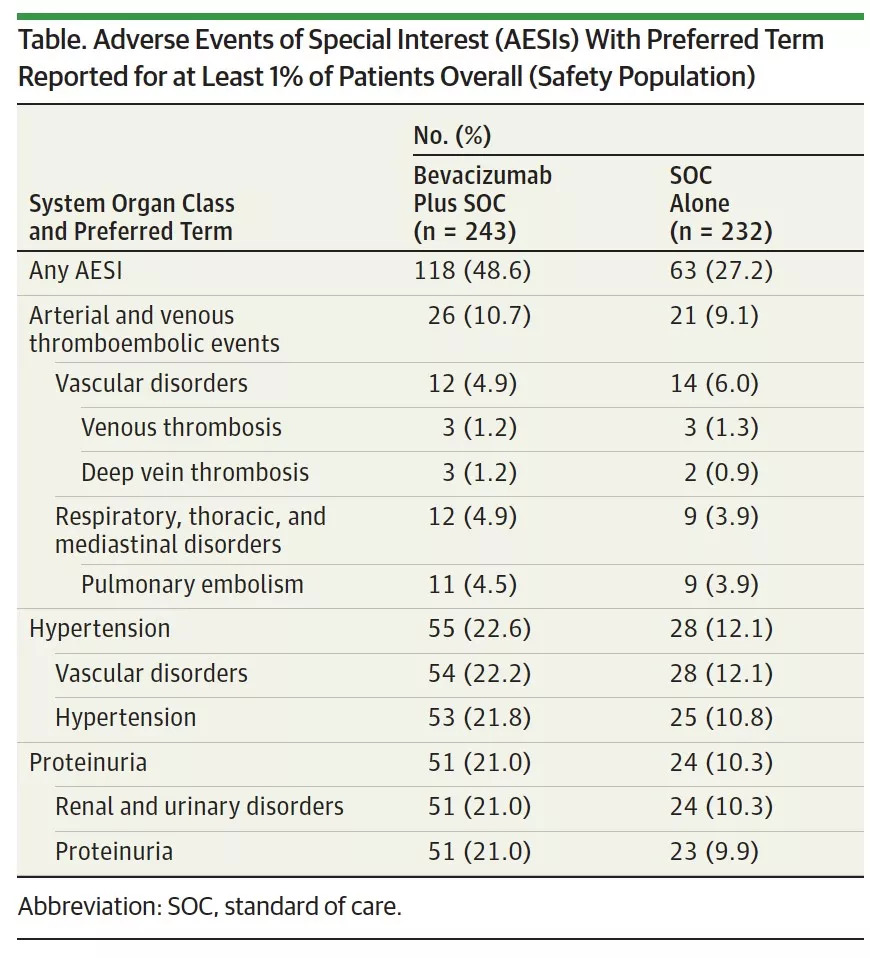
安全性分析:未观察到新的不良事件(AE),值得关注的AE总结见下表。贝伐珠单抗联合标准治疗组对比标准治疗组,值得关注的AE和3-4度AE发生率更常见,分别为48.6% vs 27.2%和76.5% vs 60.3%,总结见表1。两组分别有6.6%和5.2%的患者出现5度治疗相关AE。
表1.值得关注的AE对比
结论和讨论
AvaALL研究是第一项随机III期研究评估第一次进展后,贝伐珠单抗后续多线治疗的疗效。结果显示,在NSCLC患者中,贝伐珠单抗跨线治疗并不能显著提高疗效,未观察到OS的显著获益,也未观察到新的不良事件。
Safety and Efficacy of Bevacizumab Plus Standard-of-Care Treatment Beyond Disease Progression in Patients With Advanced Non–Small Cell Lung Cancer The AvaALL Randomized Clinical Trial. JAMA Oncol. doi:10.1001/jamaoncol.2018.3486
相关内容
社会学/环境学(社会统计学,心理学,人口学,空间统计学,环境统计学等)
工业工程学(质量控制,可靠性分析等)
经济学/金融学(精算学,金融统计学等)
工程学/计算机科学(统计学习,数据挖掘,信号/图像采样/处理等)
基础科学(统计物理学,统计化学等)