OA 09.06 IB期研究扩展队列:Savolitinib联合吉非替尼用于EGFR突变MET扩增的晚期NSCLC
【WCLC 2017精彩盘点】C-MET靶点研究新进展
在NSCLC患者中,MET基因变异的形式多样,包括基因扩增,exon14跳跃突变,过表达等。MET基因变异既介导了EGFR TKI的耐药,又单独作为晚期NSCLC患者的潜在治疗靶点。在本次的世界肺癌大会上,有多个研究是关于MET变异患者潜在治疗策略的研究报道,本文盘点了本次WCLC会议上关于C-MET靶点研究的精彩内容。
(一)探寻EGFR-TKI耐药后MET扩增患者的耐药后治疗策略
本研究是一项开放的IB期研究,旨在EGFR TKI耐药的中国晚期NSCLC患者中评估Savolitinib联合吉非替尼的疗效。扩展队列中,入组EGFR突变MET扩展的晚期NSCLC患者。MET扩增定义为FISH法检测,肿瘤组织MET/CEP7比值≥2或MET基因拷贝数≥5。患者接受Savolitinib 600mg/天+吉非替尼250mg/天治疗,计划入组50例患者。主要终点为联合方案的安全性、耐受性和推荐的II期研究剂量。
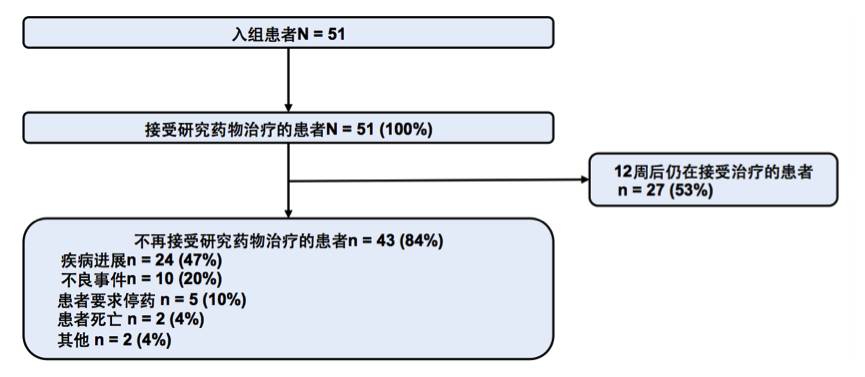
共入组51例患者,中位年龄61岁,EGFR T790M阳性、阴性和状态未知的患者分别为23例(45%),23例(45%)和5例(10%)。本研究的最后随访日期为2017年8月21日,患者目前的治疗情况总结见下图。
图:至最后随访日期患者的治疗信息
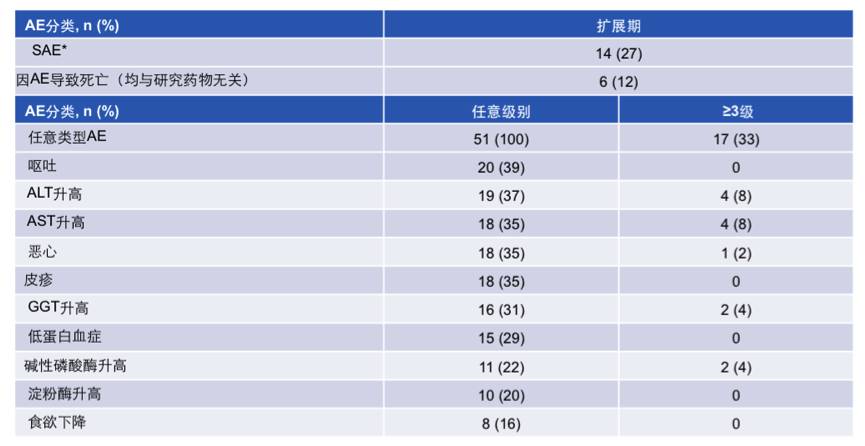
安全性分析:最常见的(发生率≥15%)不良事件(AE)汇总见下表。≥3级的AE发生率为33%;SAE的发生率为27%,最常见的SAE为AST升高(4%,n=2)和肝功能损伤(4%,n=2);因AE导致死亡的患者6例,但均与研究药物无关。
表:最常见的(发生率≥15%)不良事件(AE)汇总
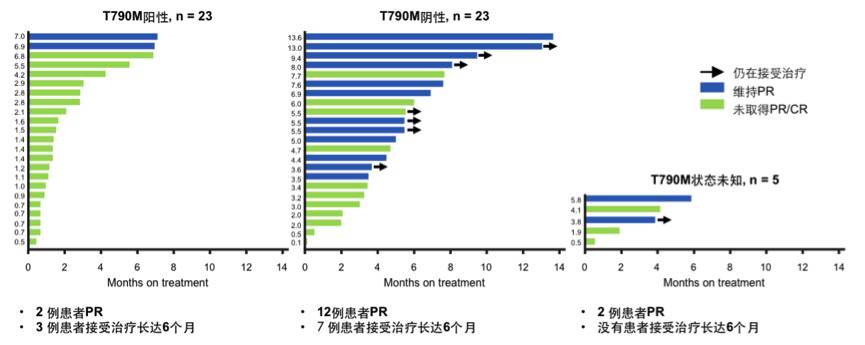
据患者T790M突变状态进行疗效分析, T790M阳性,阴性和突变状态未知的患者,ORR分别为9%,52%和40%,总的ORR为31%。疗效数据总结见下表。
表:不同T790M突变状态患者的疗效分析
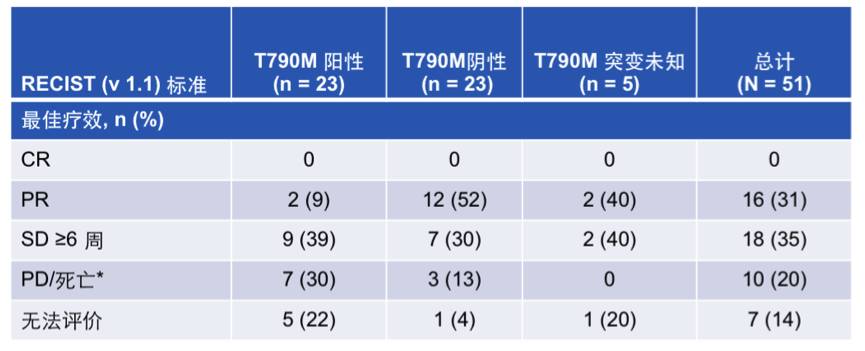
图:患者接受联合方案的最佳疗效和用药持续时间
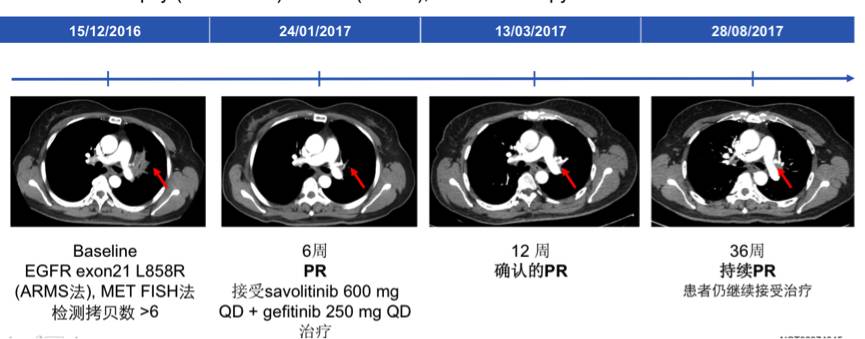
研究者同时汇报了1例接受联合方案取得PR的病例。51岁女性,EGFR突变阳性,接受一线吉非替尼治疗,最佳疗效PR,PFS 3.8个月。2015年11月25日耐药后活检发现EGFR L858R突变(ARMS法),FISH法检测MET拷贝数>10,接受联合方案治疗,最佳疗效PR,目前已服药36周,仍维持PR继续服药。治疗过程中的影像学变化总结如下。
图:患者治疗过程中的影像学变化
结论:Savolitinib联合吉非替尼方案安全耐受,推荐Savolitinib 600mg/天+吉非替尼250mg/天作为II期研究的推荐剂量。在EGFR TKI耐药后的EGFR突变MET扩增的NSCLC患者中,联合方案显示出初步的抗肿瘤疗效,尤其在T790M阴性的患者,支持后续进一步的研究。
OA 09.03 TATTON研究IB期扩展队列:奥希替尼联合Savolitinib治疗EGFR-TKI耐药后MET扩增的NSCLC
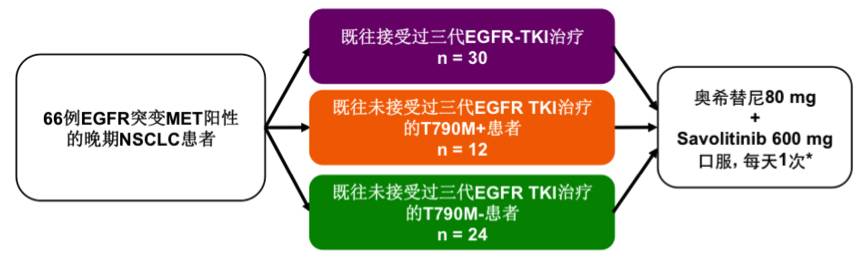
研究旨在评估Savolitinib联合奥希替尼方案用于EGFR突变MET阳性NSCLC患者的安全性和初步疗效。入组≥18岁的局部晚期或转移性EGFR突变NSCLC患者,既往接受过≥1线的EGFR TKI治疗,WHO PS评分0-1分。MET阳性定义为FISH法检测MET基因拷贝数≥5或MET/CEP7比值≥2。MET过表达(IHC法,3+细胞≥50%)或NGS检测阳性的患者也可以入组。
共入组66例患者,中位年龄为59.5岁,女性38例(58%),亚裔57例(86%)。根据患者既往是否接受过3代EGFR TKI治疗和T790M突变状态分为3组:1. 既往接受过3代EGFR TKI治疗(n=30);2. 既往未接受过3代EGFR TKI治疗T790M突变的患者(n=12);3. 既往未接受过3代EGFR TKI治疗T790M阴性的患者(n=24)。研究入组患者情况总结如下。
图:研究入组患者情况
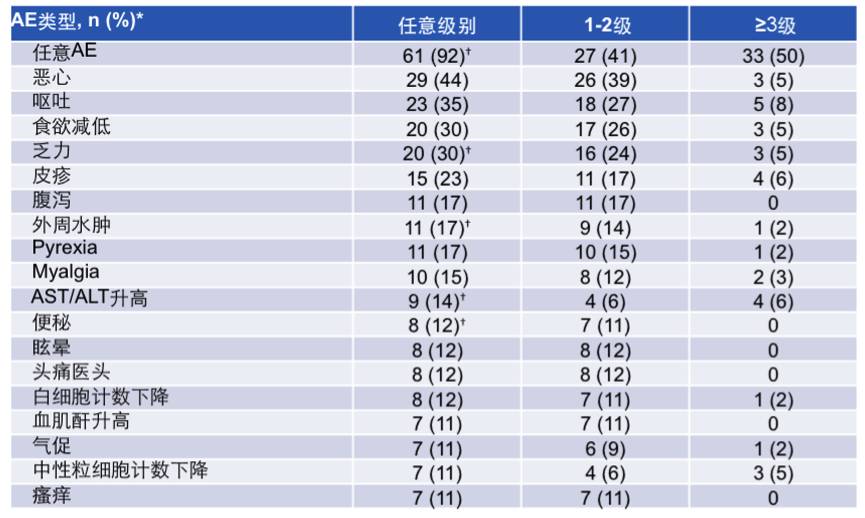
安全性分析:最常见的(≥10%)AE总结见下表,≥3级的AE发生率为50%。最常见的AE为恶心,呕吐,食欲减低,乏力和皮疹。
表:最常见的(≥10%)AE总结
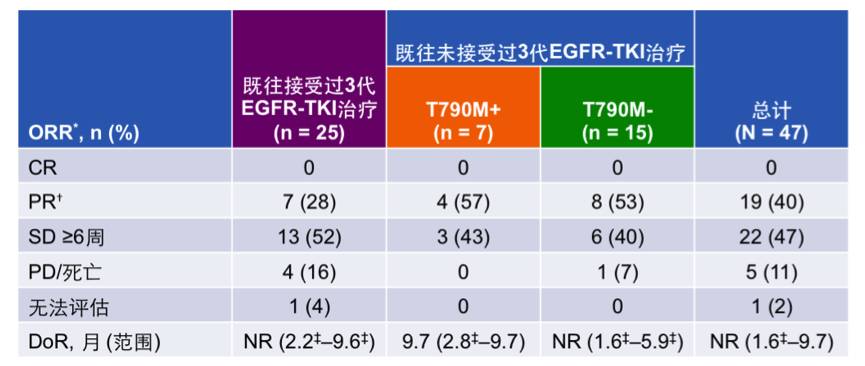
分析经中心实验室确认的MET阳性患者(N=47)的疗效。结果显示,既往接受过三代EGFR TKI治疗的患者,接受联合方案治疗的ORR为28%;既往未接受过三代EGFR TKI治疗的T790M突变患者,ORR为43%;T790M野生型的患者,ORR为40%;总体人群的ORR为40%。
表:经中心实验室确认为MET阳性患者的初步疗效分析(N=47)
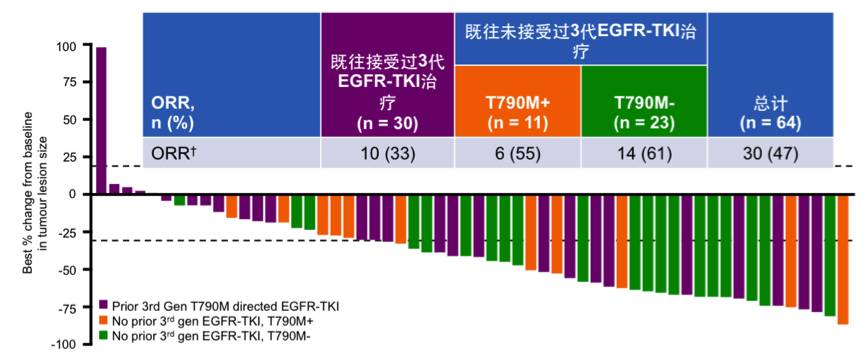
在所有入组的MET阳性患者中(N=64),既往接受过三代EGFR TKI治疗的患者,接受联合方案治疗的ORR为33%;既往未接受过三代EGFR TKI治疗的T790M突变患者,ORR为55%;T790M野生型的患者,ORR为61%;总体人群的ORR为47%,总体如下。
表:所有入组的MET阳性患者的初步疗效分析(N=64)
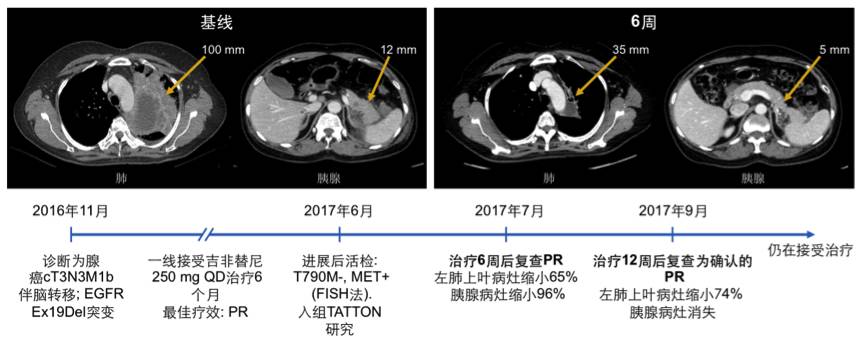
研究者还报道了1例接受联合方案治疗取得PR的病例。57岁女性,非吸烟肺腺癌患者,ECOG PS评分1分。2016年11月诊断为肺腺癌cT3N3M1b伴脑转移; EGFR Ex19Del突变,一线接受吉非替尼250 mg QD治疗6个月,最佳疗效PR。2017年6月,进展后活检T790M-, MET+ (FISH法),入组TATTON研究。2017年7月,治疗6周后复查,疗效评价为PR(左肺上叶病灶缩小65% 胰腺病灶缩小96%);2017年9月,治疗12周后复查,疗效评价为确认的PR(左肺上叶病灶缩小74% 胰腺病灶消失),目前仍在接受治疗。影响学变化和病史总结见下图。
图:患者的影响学变化和病史总结。
结论:与TATTON研究A部分结果一致,奥希替尼联合savolitinib方案安全耐受。在所有MET阳性的患者中,无论患者的T790M突变状态和既往是否接受过三代EGFR TKI治疗,这一联合方案都显示出令人兴奋的抗肿瘤疗效。目前这一扩增队列仍在继续招募患者。基于初步的研究结果,支持后续在更大样本的人群中进行研究,也可以探索这一方案用于前线治疗。
小结
MET扩增是一代EGFR TKI耐药的主要机制之一,在三代EGFR TKI奥希替尼耐药的患者中,也检测到MET扩增。对于这类患者,联合使用EGFR TKI和MET TKI有望逆转耐药。上述两个IB期研究分别评价了吉非替尼或奥希替尼联合MET KI用于savolitinib用于EGFR TKI耐药后MET扩增的患者,研究结果提示两种联合方案安全耐受,并显示出初步的抗肿瘤疗效。需要注意的是,EGFR TKI耐药患者,耐药机制非常复杂,可能存在T790M突变合并MET基因扩增,对不同耐药机制的患者,需要采用不同的联合治疗方案来克服耐药。两个研究初步的结果还是非常振奋人心的,期待后续大样本的研究进一步确认,为克服MET扩增介导的耐药提供重要的治疗策略。
(二)MET基因扩增型NSCLC患者的基因特征分析
OA 12.08对MET基因簇状扩增和非簇状扩增的NSCLC患者进行全面基因组分析
MET基因位于7号染色体,全长125kbp,MET基因扩增定义为拷贝数≥6个。根据MET基因扩增片段的大小分为簇状扩增和非簇状扩增。簇状MET扩增定义为,扩增片段<20Mbp,扩增片段占据7号染色体的比例<15%,通常只包含一个或几个基因。大的非簇状或“广泛”(扩增片段>20Mbp),扩增片段占据7号染色体很大一部分,包括了大量的扩增基因。
研究采用杂交捕获的CGP检测18200例NSCLC患者,其中MET基因扩增的患者545例(发生率约为3%),其中457例(84%)为簇状扩增(扩增片段<20Mb),扩增片段的中位长度为2Mbp;88例(16%)患者为非簇状扩增,扩增片段的中位长度为46Mbp。
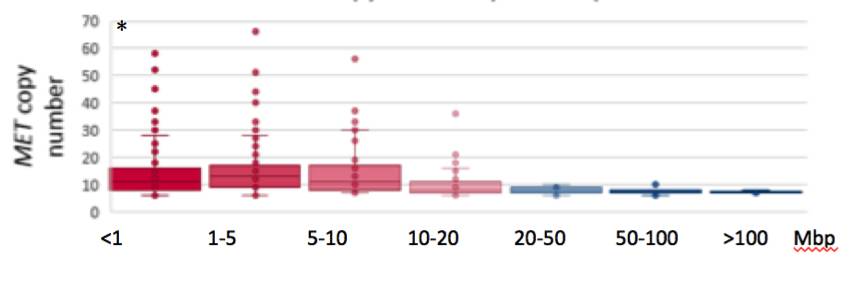
MET基因拷贝数的范围为6-144,中位拷贝数为10。簇状扩增的患者中,MET基因的中位拷贝数为11;非簇状扩增患者,MET基因的中位拷贝数为7,两者有统计学差异(P<0.001)。
图:不同MET扩增子的拷贝数
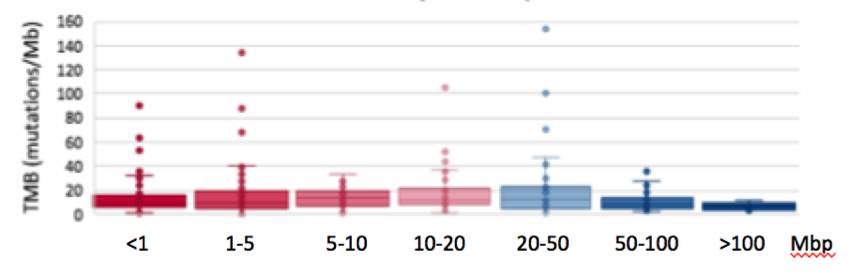
对比簇状和非簇状MET扩增患者的肿瘤突变负荷(TMB),中位TMB分别为11 vs. 9mut/Mb,无统计学差异(P=0.47)。
图:不同MET扩增子患者的TMB
对比簇状扩增和非簇状扩增患者其他共存基因的发生率。结果显示,在MET非簇状扩增患者中,有更高比例合并共存基因。总体而言,MET簇状扩增患者和非簇状扩增患者中,合并其他驱动基因变异的患者比例分别为33%和51%,这说明NSCLC的驱动基因还是存在互斥现象。其中,MET exon14外显子跳跃突变和EGFR突变是最常见的共存基因,在簇状扩增患者中的比例分布为8%和16%;在非簇状扩增患者中的比例为10%和23%。
图:对比簇状扩增和非簇状扩增患者其他共存基因的发生率
会上还分享了1例临床病例,55岁亚裔女性肺腺癌患者,2015年诊断为晚期肺癌,EGFR exon19del突变。合并脑转移,进行了脑部转移灶切除术,对脑转移病灶进行CGP检测发现EGFR exon19del突变+MET基因非簇状扩增,9个拷贝数。接受阿法替尼治疗3个月后进展,最佳疗效PR,疾病进展后,重新对进展的肺部转移灶进行活检,发现为SCLC转化。CGP检测发现肺转移灶为EGFR exon19del+ MET基因非簇状扩增,无T790M突变。患者后续因为SCLC转化接受EP方案化疗,反应良好,因为脑转移接受奥希替尼治疗。对于这例患者,是否因为共存的MET基因变异导致阿法替尼的疗效持续时间较短?但阿法替尼又取得了PR的疗效,这是否说明非簇状扩增的MET基因并不是驱动基因,至少在伴随7号染色体广泛扩增的患者中?
结论:在MET扩增的NSCLC患者中,MET扩增子的大小存在很大的变异。关于MET基因“簇状扩增”和“非簇状扩增”的准确cut-off值需要后续更多的研究,需要和患者接受MET TKI的疗效及MET FISH法检测的拷贝数(MET/CEP7)。太过保守的cutoff值(如2Mbp),可能会排除了很大一部分能从MET TKI治疗中获益的患者,然而如果cutoff值定的太随意,又会包括一部分不能从MET抑制剂治疗中获益的患者,这将会影响药物的研发。
小结
MET基因变异的形式多样,目前关于确定MET为驱动基因的最佳生物标志物尚未明确。这一研究采用NGS检测对不同MET扩增的患者进行基因特征分析,有助于明确哪一种基因变异类型患者,可以从MET抑制剂的治疗中真正获益。
(三)MET变异作为NSCLC的治疗靶点
P2.04-005 一项II期多中心临床研究GENOMETRY mono-1,探索MET抑制剂Capmatinib(INC280)用于EGFR野生型MET变异的晚期NSCLC患者
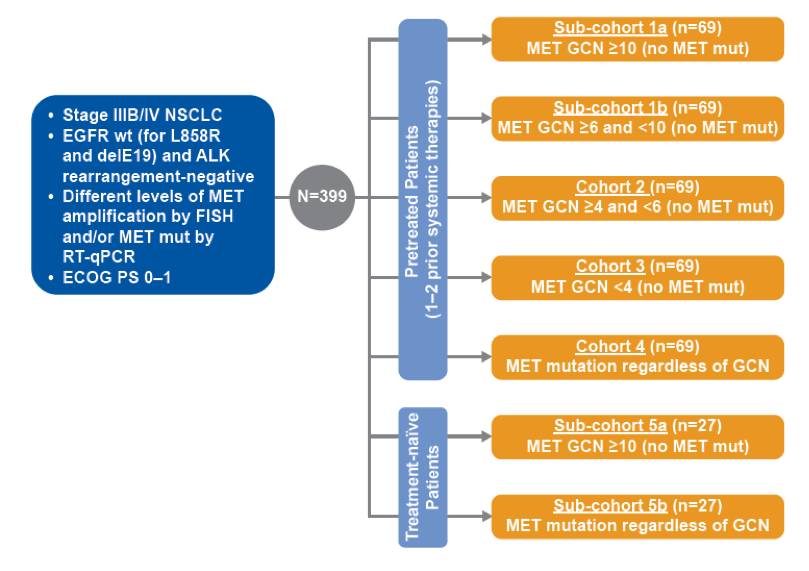
这是一项开放的II期研究,计划入组399例EGFR野生型,ALK阴性,MET基因扩增和/或MET exon14跳跃突变型晚期NSCLC患者。基于患者既往的治疗情况和MET扩增水平和/或突变状态,分别入组至7个不同的队列/亚队列。在(亚)队列1-4中,要求患者既往接受过1-2线系统性治疗;而队列5为初治患者。研究设计如下。
图:GENOMETRY mono-1研究设计(GCN,基因拷贝数)
所有入组患者接受capmatinib 400mg,每天2次,口服治疗,连续服药,21天为1个周期。主要研究终点为独立评估委员会评价的ORR(各个队列或亚队列)。
初步数据提示MET突变和MET扩增(尤其是GCN≥10个)是capmatinib的疗效预测标志物。在MET突变(图A)、MET突变伴MET高水平扩增(GCN≥10个,图B)和MET高水平扩增(GCN≥10,图C)的患者中均可观察到疗效。下图显示了不同MET变异类型患者接受capmatinib治疗后,观察到肿瘤显著缩小。
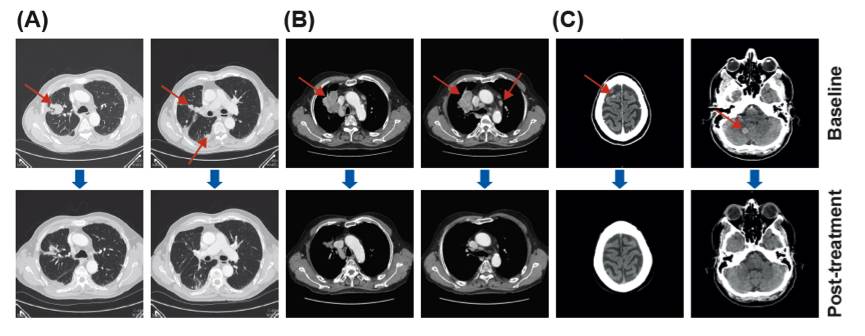
图:不同MET变异类型的晚期NSCLC患者接受capmatinib治疗后的影像学变化
图A:1例80岁的女性,MET GCN 5.2伴MET突变,二线接受capmatinib治疗后6周的影像学变化。目前患者正在接受第16个周期的研究药物治疗,持续PR。
图B:1例78岁的男性患者,MEG GCN 22.8伴MET突变,二线接受capmatinib治疗后24周的影像学变化。二线接受capmatinib治疗后6周的影像学变化。目前患者正在接受第16个周期的研究药物治疗。
图C:1例45岁的女性患者,合并脑转移未进行治疗,MEG GCN 16.5,不伴MET突变,二线接受capmatinib治疗后6周的影像学变化。接受药物治疗7个周期后因为颅外进展停药。
截至2017年8月30日,中心实验室已经检测到81例MET GCN≥10的患者和99例MET突变的患者。14.5% MET突变的NSCLC患者同时伴随MET GCN≥10。
结论:GENOMETRY mono-1研究旨在探索capmatinib用于初治或经治的晚期EGFR野生型MET扩增和/或MET突变患者的疗效和安全性。结果显示MET突变和MET扩增的患者均观察到抗肿瘤疗效。目前,研究队列1a,4,5a和5b仍在继续招募患者,包括初治和经治患者,期待后续研究结果。
小结
对MET靶点的研究经历了很长的一个过程,最初的研究因没有基于最佳的生物标志物进行入组人群筛选,均以失败告终。本研究中采用创新的设计,先在I期研究中筛选出最有可能获益的人群,再进行II期研究探索,并在II期研究时,根据患者既往的治疗情况和分子特征分为不同队列进行分析。初步数据显示出capmatinib较好的疗效和安全性,期待后续更多的研究数据报道。
28个肿瘤相关临床试验招募患者
点击下方图片即可查看详情