基本情况
美例秀秀|我命由我不由天,合理抗HER才能让HER2阳性乳腺癌生存获益

第72例
HER2是乳腺癌明确的重要驱动基因,在抗HER2治疗不可及时,HER2阳性乳腺癌是预后最差的分子类型。抗HER2治疗的应用,显著改变了这类患者的疾病进程。对于早期HER2阳性乳腺癌,曲妥珠单抗/帕妥珠单抗治疗使大多数患者走向了治愈。即使是复发转移性HER2阳性乳腺癌,做好解救治疗特别是规范化的全程抗HER2治疗,仍有望使这类患者获得长期生存。
德国海德堡大学肿瘤学博士
华中科技大学博士研究生导师
石河子大学硕士研究生导师
石河子大学医学院第一附院肿瘤内科主任
石河子大学临床医学院肿瘤学教研室主任
兵团肿瘤性疾病质控中心主任
兵团医学会肿瘤学分会主任委员
中国抗癌协会肺癌专业委员会内科学组成员
中国医师协会中西医结合医师分会第三届肿瘤病学专业委员会常务委员
中国生命关怀协会肿瘤无创治疗专业委员会副主任委员
中国医疗保健国际交流促进会神经内分泌肿瘤分会常务委员
中国医药教育协会肿瘤免疫治疗专业委员会常务委员
国家肿瘤质控中心乳腺癌专家委员会委员
吴阶平医学基金会肿瘤多学科诊疗专业委员会常务委员
中国临床肿瘤学会胰腺癌专家委员会委员
北京肿瘤防治研究会转化医学分委会常委
首届中国研究型医院学会精准医学与肿瘤MDT专业委员会消化临床研究学组副组长
新疆抗癌协会肿瘤精准治疗专业委员会第一届委员会副主任委员
新疆抗癌协会化疗专业委员会副主任委员
新疆医学会第四届肿瘤治疗专业委员会常务委员
新疆抗癌协会第三届理事
新疆医学会抗癌协会心理社会肿瘤学专业委员会常委
《临床肿瘤学》杂志编委
《农垦医学》杂志审稿专家
石河子大学第一附属医院 肿瘤内科
新疆抗癌协会肿瘤营养委员会委员
兵团医学会肿瘤MDT专委会秘书
患者女性,1958年生,2010年绝经,维吾尔族,长期居住于新疆沙湾县,既往体健,无吸烟饮酒史,否认肿瘤及遗传病家族史,ECOG 1 分。
既往手术及新辅助-辅助治疗阶段
2014年4月4日,患者因“发现左乳包块半年”就诊于乳腺外科。体检:左乳外上象限触及约4.5*3.5cm包块,与胸壁不固定,乳房皮肤无殊,左腋窝及左锁骨上未及肿大淋巴结。行左乳包块穿刺活检,病理为乳腺浸润性导管癌,中分化,免疫组化:ER(-)PR(-) HER2(3+)Ki67(20%)。临床分期cT2N0M0(ⅡA期)。分别于2014年4月11日、5月6日行“多西他赛+表柔比星+环磷酰胺”新辅助化疗。2周期新辅助化疗后肿瘤明显缩小,患方不愿意继续化疗,坚决要求先行手术,遂于2014年5月29日行左乳癌改良根治术。术后病理为:左乳浸润性导管癌,中分化,肿瘤大小约2..5cm×1.7cm×1.5cm,未见脉管瘤栓,腋窝淋巴结0/15。免疫组化:ER(-)PR(-) HER2(3+)Ki67(15%)。术后分期:pT2N0M0(ⅡA期),HER2阳性型。术后患者再接受“多西他赛+表柔比星+环磷酰胺”化疗4周期。患者在新辅助-辅助治疗阶段因经济原因未行曲妥珠单抗等靶向治疗。
疾病进展阶段
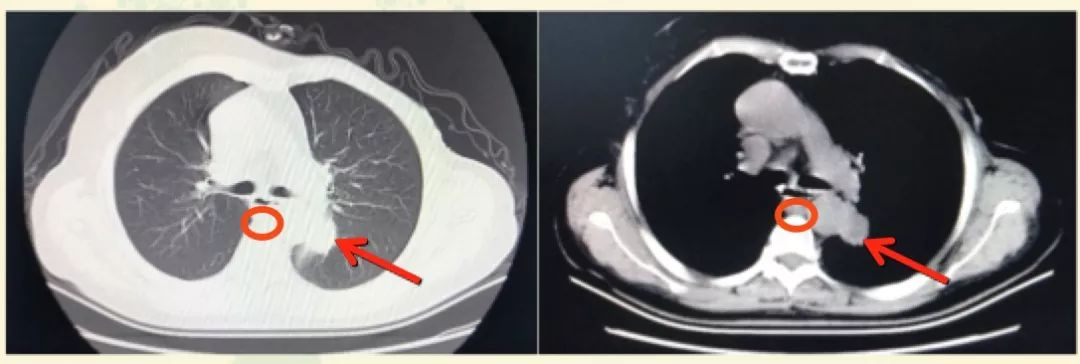
2018年12月起,患者进食梗咽感并进行性加重至无法进食。CT检查发现纵隔淋巴结转移、肺转移、左肾上腺转移。请消化内科会诊,认为无法进食系纵隔淋巴结转移压迫食管所致,遂行食管扩张术,鼻饲管全流质饮食。超声检查示左侧锁骨上窝低回声结节3.18×2.54cm,考虑淋巴结转移。CA15-3为80.7U/mL。左侧锁骨上淋巴结穿刺活检,病理示:小灶转移性腺癌,符合转移性乳腺癌,免疫组化:ER(-)PR(-)HER2(3+)。患者拒绝肺穿刺病理学检查。
图1. 2018年12月胸部CT检查
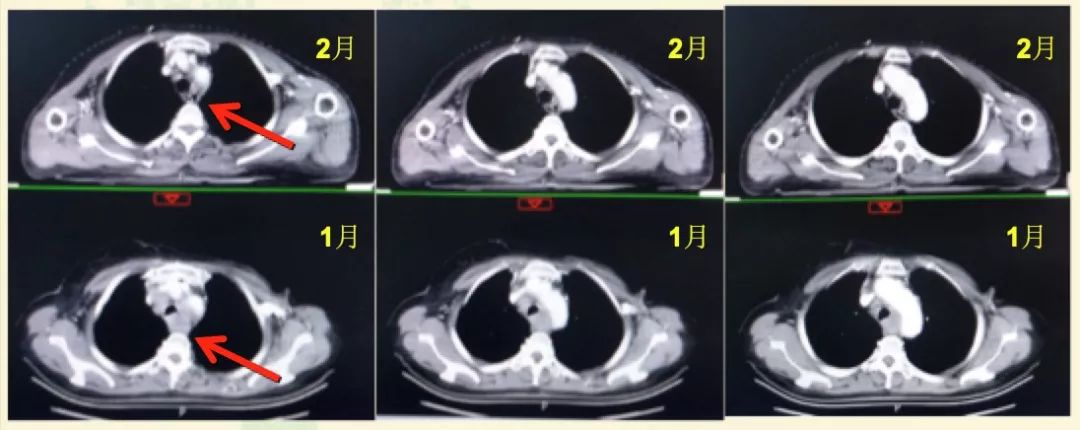
于2019年2月1日起行“曲妥珠单抗+紫杉醇(qw*3)方案治疗两周期,2019年3月14日复查,超声示左锁骨上窝结节1.73×1.70cm,较前缩小。胸部CT示左纵隔淋巴结及左肺下叶背段转移瘤与前片比较明显缩小。CA15-3降至52.18U/ml。
图2. 治疗前后胸部CT对比
患者拒绝继续化疗,遂继续接受曲妥珠单抗维持治疗,每3周一次,并给予左锁骨上及纵隔区放疗,患者放疗结束后拔除鼻饲管恢复正常饮食。肿瘤标志物CA15-3复查已正常范围。目前仍继续接受曲妥珠单抗治疗中,未发现病灶进展及新发转移病灶。
点评专家
主任医师、教授、研究生导师
中科院大学肿瘤医院(浙江省肿瘤医院)乳腺外科主任
浙江省医师协会乳腺肿瘤专委会主委
中国医师协会乳腺疾病专委会常委
中华医学会肿瘤学乳腺学组委员
中国医药教育协会乳腺专委会副主委、浙江分会主委
《中国肿瘤》、《肿瘤学杂志》、《中华内分泌外科杂志》、《中华乳腺病杂志》等编委
点评
1.新辅助治疗-辅助治疗阶段
早期乳腺癌治疗的目标是治愈。浙江省乳腺癌新辅助治疗专家共识(2018)(简称浙江共识,下同) 指出:新辅助治疗较辅助治疗在某些亚型中(如HER2阳性型和三阴性型)可能更具有疗效优势和生存获益。本病例初诊时临床上虽然没有区域淋巴结转移,但原发灶4.5cm偏大,选择行新辅助治疗是合理的。NOAH研究【1】证明了HER2阳性患者接受新辅助化疗加入曲妥珠单抗可显著提高PCR率,并改善无事件生存。HER2共有两种活化机制,非配体依赖和配体依赖的激活模式。随着抗HER2靶向治疗药物帕妥珠单抗的问世,曲妥珠单抗和帕妥珠单抗的联合分别阻滞了两种活化方式,实现了HER2的特异、有效、互补的全面阻滞。NeoSphere研究【2】提示曲妥珠单抗与帕妥珠单抗双靶向联合化疗较曲妥珠单抗联合化疗可进一步提高PCR率。在亚太人群中进行的HER2阳性乳腺癌新辅助治疗PEONY研究【3】同样提示了曲妥珠单抗和化疗的基础上增加帕妥珠单抗可以进一步提高PCR。所以浙江共识指出:HER2阳性新辅助治疗应常规包括靶向抗HER2治疗,在药物可及的情况下推荐使用化疗联合曲妥珠单抗和帕妥珠单抗双靶的方案。四大临床研究(HERA、N9831、B31、BCRG006)超过1万病例证实在辅助化疗的基础上加用曲妥珠单抗1年明显提高了HER2阳性乳腺癌的无病生存和总生存。APHINITY研究【4】临床试验,入组4805例HER2阳性乳腺癌患者,研究结果显示,中位随访45.4个月,曲妥珠单抗+化疗辅助治疗的基础上加用帕妥珠单抗,能够降低复发风险19%(HR0.81;95%CI 0.66~1.0;P=0.045),淋巴结阳性、受体阴性人群获益更大。该患者为受体阴性,虽然化疗后手术标本病理检查淋巴结阴性,但并不排除新辅助前阳性可能,该患者可能是帕妥珠单抗较好的获益人群。虽然患者初诊时为2014年,帕妥珠单抗不可及,但也应该在新辅助/辅助阶段使用曲妥珠单抗。该患者因经济原因未行曲妥珠单抗等靶向治疗,虽然TEC新辅助化疗2周期后肿瘤也明显缩小,后行手术及术后化疗。但靶向治疗所缺,为该患者术后肿瘤复发转移埋下了伏笔。
2.晚期解救治疗
对于复发转移性HER2阳性乳腺癌,做好解救治疗特别是规范化的全程抗HER2治疗,仍有望使这类患者获得长期生存。H0648g【5】研究和M77001研究【6】证实在紫杉类基础上联合曲妥珠单抗治疗能够显著提高PFS和OS,确立了曲妥珠单抗联合紫杉类在一线治疗的标准地位。M77001研究这项Ⅱ期临床试验结果显示曲妥珠单抗+多西他赛组的ORR为61%(95%CI 50%~71%),单用多西他赛组的ORR为34%(95%CI 25%~54%)。两组中位OS为31.2个月和22.7个月(P=0.0325)。H0648gⅢ期研究同样证实了曲妥珠单抗在晚期一线治疗的标准地位。CLEOPATRA研究【7】则是随机、双盲、安慰剂对照、多中心的Ⅲ期试验,研究纳入HER2阳性、转移或局部复发或不能手术切除的乳腺癌患者随机进行曲妥珠单抗+帕妥珠单抗+多西他赛或曲妥珠单抗+安慰剂+多西他赛的治疗,2019年ASCO最新的OS结果分析显示,帕妥珠单抗+曲妥珠单抗+紫杉醇对比曲妥珠单抗+紫杉醇具有显著的生存获益,中位OS分别为57.1个月和40.8个月(绝对差异16.3个月;HR 0.69;95%CI 0.58~0.82),两组8年OS率分别达到37%和23%。随着帕妥珠单抗2018年12月在国内批准上市,妥妥双靶加化疗的方案也成为中国患者的首选晚期一线治疗方案。获益于2017年起的曲妥珠单抗降价并纳入医保,使得该患者晚期一线治疗在紫杉类基础上加用了曲妥珠单抗,该方案也是可选方案之一。
我们希望该患者一线治疗能够获得很长的PFS,但多数情况下难免会有疾病进展的时候。假如该患者在曲妥珠单抗维持治疗过程中疾病进展,可以有如下几种选择:①建议患者参加符合入组条件的设计科学的临床研究;②可以在曲妥珠单抗基础上加回化疗包括紫杉(因为前期紫杉醇并不是疾病进展后停用)、卡培他滨等;③在曲妥珠单抗基础上加用帕妥珠单抗;④其他:包括T-DM1及小分子TKI靶向药物等。
【1】Gianni Luca,Eiermann Wolfgang,Semiglazov Vladimir et al. Neoadjuvant and adjuvant trastuzumab in patients with HER2-positive locally advanced breast cancer (NOAH): follow-up of a randomised controlled superiority trial with a parallel HER2-negative cohort.[J] .Lancet Oncol., 2014, 15: 640-7.
【2】Gianni Luca,Pienkowski Tadeusz,Im Young-Hyuck et al. 5-year analysis of neoadjuvant pertuzumab and trastuzumab in patients with locally advanced, inflammatory, or early-stage HER2-positive breast cancer (NeoSphere): a multicentre, open-label, phase 2 randomised trial.[J] .Lancet Oncol., 2016, 17: 791-800.
【3】Shao Z, Pang D, Yang H, et al. Pertuzumab, trastuzumab, and docetaxel for HER2-positive early or locally advanced breast cancer in the neoadjuvant setting: Efficacy and safety analysis of a randomized phase III study in Asian patients (PEONY). SABCS.,2018,P6-17-17.
【4】Adjuvant Pertuzumab and Trastuzumab in Early HER2-Positive Breast Cancer.[J] .N. Engl. J. Med., 2017, 377: 702.
【5】Slamon D J,Leyland-Jones B,Shak S, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2.[J] .N. Engl. J. Med., 2001, 344: 783-92.
【6】Marty M,Cognetti F,Maraninchi D, et al. Randomized phase II trial of the efficacy and safety of trastuzumab combined with docetaxel in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer administered as first-line treatment: the M77001 study group.[J] .J. Clin. Oncol., 2005, 23: 4265-74.
【7】 End-of-study analysis from the phase III, randomized, double-blind, placebo (Pla)-controlled CLEOPATRA study of first-line (1L) pertuzumab (P), trastuzumab (H), and docetaxel (D) in patients (pts) with HER2-positive metastatic breast cancer (MBC). 2019 ASCO,abs1020.