从临床研究进展探索免疫治疗的另一面——超进展
近年来,以PD-1/PD-L1单抗为代表的免疫检查点抑制剂(ICI)在多种癌症中取得了突破。虽然很多患者在免疫治疗中取得了长期生存获益,但也有部分患者在免疫治疗后出现肿瘤快速进展现象,称为超进展(hyperprogressive disease,HPD)。HPD影响患者的预后,但其并不是免疫治疗的特有现象,化疗和靶向治疗也有HPD的报道。现就免疫治疗HPD的影响因素,尤其是HPD相关基因的研究现状做一梳理。
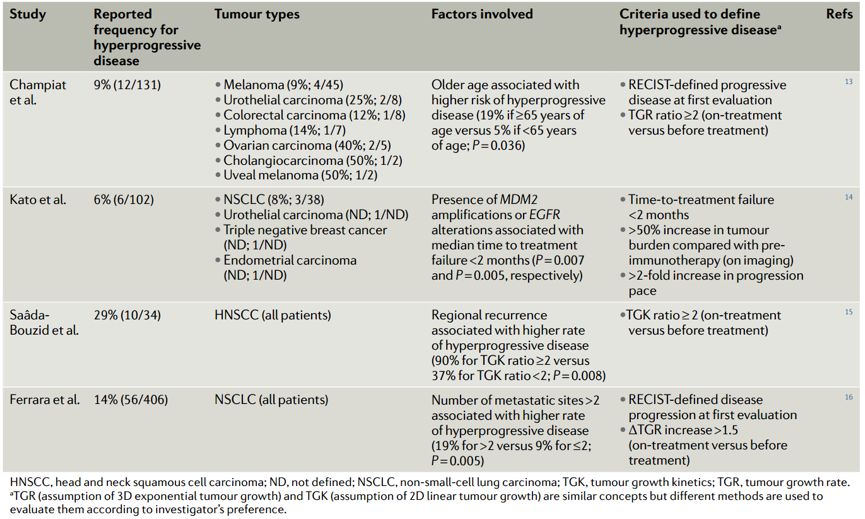
HPD在多种癌症类型的免疫治疗过程中均可发生,在黑色素瘤中发生率为9%[1],非小细胞肺癌为8%~21%[2],胃癌为11%[3],头颈部鳞状细胞癌为29%[4]。但对于HPD尚无标准定义,目前较为公认的是,在免疫治疗后肿瘤进展满足以下三个条件方可判定为HPD:①治疗失败时间(TTF)时间<2个月;②肿瘤负荷相比于基线期增长>50%;③免疫治疗后肿瘤生长速率(TGR)增加>2倍。
研究发现,某些临床特征,如年龄(>65岁)、基线转移部位数(>2个)或局部复发等与HPD相关,但这些因素在不同研究中结果并不一致,不足以作为预测指标。
➤ 年龄
Champiat等[1]的研究显示,发生HPD患者的中位年龄高于未发生HPD的患者(65岁vs 55岁, P<0.007),这可能与老年患者免疫细胞、趋化因子、吞噬功能及胞内抗原的杀伤能力减弱等相关,但具体机制不明。而在Ferrara等[5]的研究结果却不相同,年龄大小(≥65岁和<65岁)与HPD发生率并无显著相关性。
➤ 远处转移灶数目
Ferrara等[5]的研究报道了HPD发生率与转移灶数目相关,多因素分析显示>2个部位比≤2个部位HPD发生率更高(62.5% vs 42.6%,P=0.006);但Champiat[1]团队的研究未得出同样结论。
➤ 局部复发转移
Saada-Bouzid 等[6]的研究发现,HPD的发生与局部复发转移有关,在头颈部鳞癌患者中,局部复发转移的患者服用免疫药物发生HPD的比例显著高于未发生复发转移的患者(90% vs 37%,P=0.008)。近期发表于Annals of Oncology的一项研究[7]显示,HPD的患者有更多的转移灶并伴有肝转移。
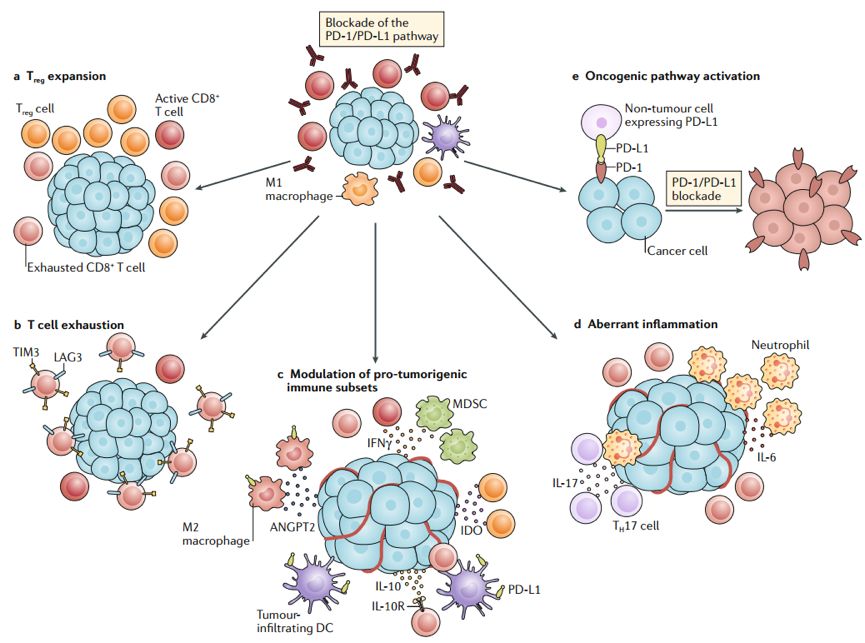
目前,引起HPD的生物学机制尚不清晰,2018年发表于Nature Reviews Clinical Oncology杂志上的综述[2]总结了PD-1/PD-L1抑制剂能导致HPD的五大机制,阻断PD-1/PD-L1通路可能:①增强调节性T细胞(Treg)功能;②旁路免疫检查点代偿性增加,导致T细胞耗竭;③影响免疫抑制性细胞群的极化,分泌免疫抑制性细胞因子;④触发不可控的炎性反应;⑤PD-1/PD-L1抑制剂可能引起致癌信号通路的激活。其中,前4项机制为形成免疫抑制微环境,协助肿瘤细胞免疫逃逸,间接加速肿瘤生长,而最后1项机制通过致癌基因的激活直接促进肿瘤细胞生长。随着多项研究的开展与深入,越来越多的证据显示基因变异为HPD风险的潜在标志物。
2017年,Kato等[8]在Clinical Cancer Research上报道了基因组变异与HPD关系的研究发现,在155例肿瘤患者中,经抗PD-1/PD-L1单药治疗后,6例存在MDM2/MDM4扩增的患者TTF<2个月;其中4例符合研究HPD定义,肿瘤体积增加55%~258%,进展速度增加分别为基线的2.3倍、7.1倍、7.2倍和42.3倍,MDM2/4扩增患者的HPD发生率远高于MDM2/4未扩增患者。另外5例具有DNMT3A突变的患者中,4例患者TTF<2个月。MDM2/4基因和DNMT3A基因突变均与免疫用药HPD密切相关。但这些HPD相关指标目前还处于个案阶段,仍需大量的临床数据支持。
此外,研究结果显示,20%(2例/10例)的EGFR突变患者出现超进展,进展速度增加为35.7倍和41.7倍。这或许可以解释EGFR突变患者接受免疫治疗效果差的原因,但无法解释出现HPD的原因。2017年欧洲肿瘤内科学会(ESMO)年会上,Singavi等 [9] 通过二代测序(Foundation Medicine, Cambridge, MA)对315个基因和19个癌症中常见重排基因的47个内含子测序,平均覆盖深度>600,发现MDM2/MDM4(66%)、EGFR(50%)和11q13位点上的基因如CCND1、FGF3、FGF4和FGF19(43%)等扩增与HPD相关,但作为HPD的预期生物标志物的作用需要在更大的队列中进一步验证。
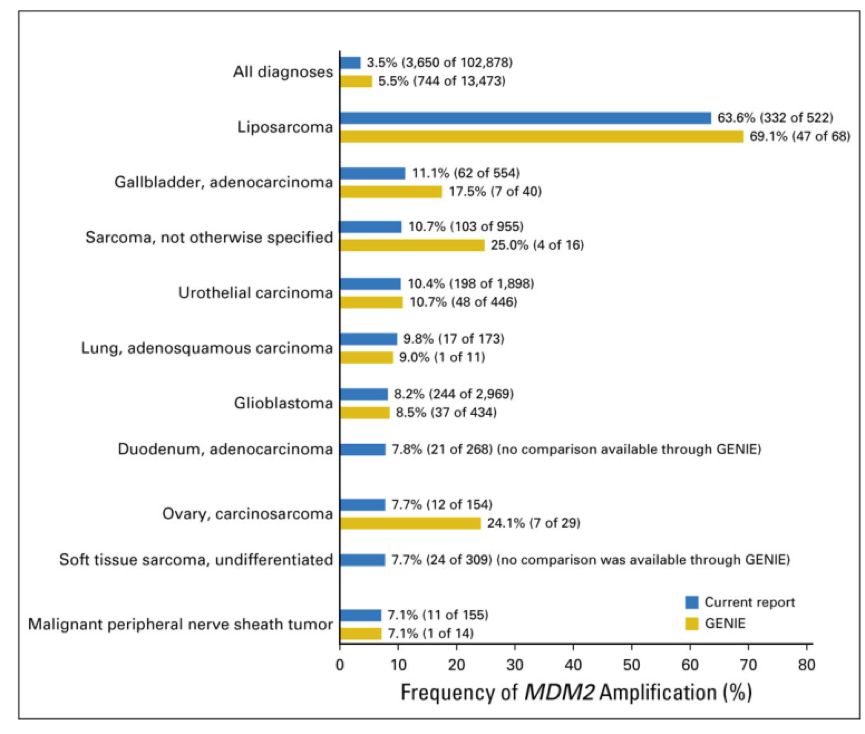
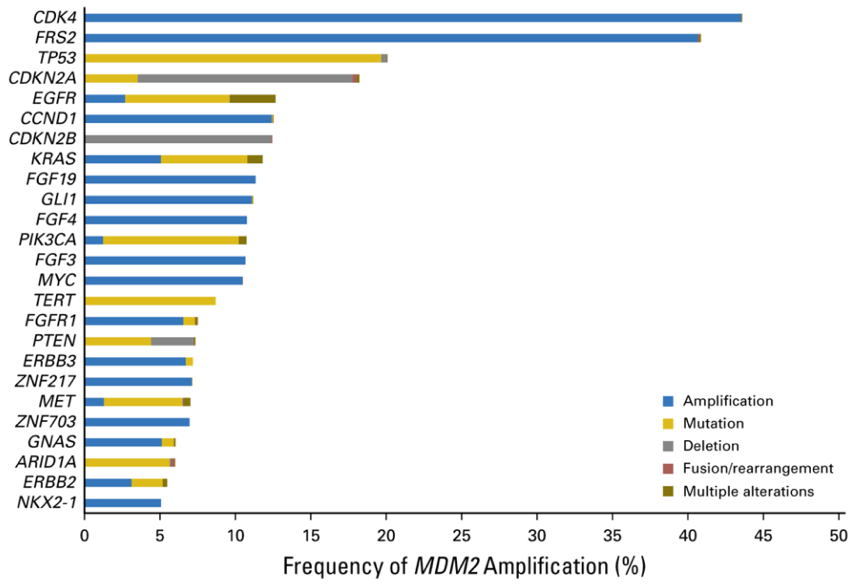
2018年发表的一项研究中,Kato等[10]进一步探索了可能与免疫治疗后HPD相关的基因标志物MDM2在多种癌症中的扩增状态,研究者通过二代测序(Foundation Medicine, Cambridge, MA)对102878例不同恶性肿瘤患者的MDM2扩增和共突变基因进行了分子水平的分析,发现3.5%(3650例)的肿瘤中存在MDM2扩增,其中99.0%(3613例)的患者存在基因组共突变,常见的共突变基因为CDK4 (43.6%)、FRS2(40.8%)、TP53(20.1%)和CDKN2A (18.2%);在2.2%(79例/3650例)的患者中发生了错配修复基因和PD-L1共突变;此外,高TMB在MDM2扩增患者中明显较少。该研究表明,大多数肿瘤类型中有一部分患者存在MDM2扩增。
近期,在2019美国临床肿瘤学会(ASCO)年会的摘要[11]中,一项非小细胞肺癌(NSCLC)回顾性研究分析了20例一线帕博利珠单抗治疗的晚期患者,其中5例患者出现了HPD,研究者通过荧光原位杂交技术(FISH) 、免疫组化(IHC)和NGS分析(FoundationOne CDx,FMI)显示,5例HPD患者均存在MDM2扩增。无一例非HPD患者IHC分析出现MDM2基因扩增或蛋白表达,也无一例非HPD患者NGS分析发现 MDM2 和/或CDKN2A/B基因改变。该研究表明,CDKN2A/B基因缺失及MDM2改变与免疫HPD密切相关。由于HPD的发生机制尚不清楚,需要更多的数据来更好地了解这些基因组改变与免疫HPD之间的联系。因此,基因检测可以帮助预测免疫治疗的HPD风险,未来也将会有更多基因标志物被发现。
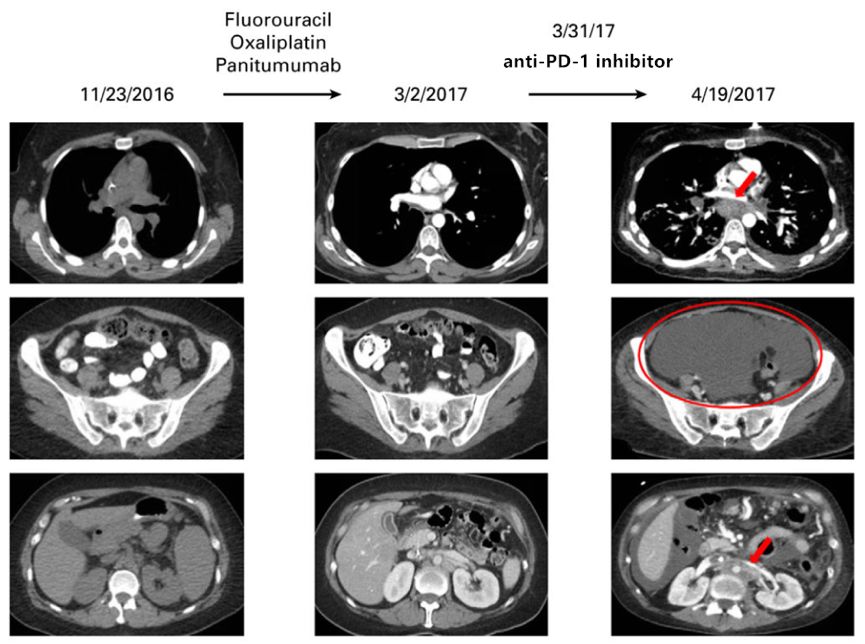
患者女,36岁,患胃食管交界处腺癌[10]。在接受氟尿嘧啶、奥沙利铂和帕尼单抗二线治疗时,病情稳定(下图,左边和中间),由于患者出现亚厘米淋巴结病变,方案改为PD-1抑制剂。治疗3周内,患者纵隔、腹膜后淋巴结进展迅速,出现大量腹水,进展速度较检查点阻断前4个月增加6.4倍,肿瘤负荷较免疫治疗前影像学增加460%。随后治疗改为氟尿嘧啶、奥沙利铂和曲妥珠单抗,但患者在使用PD-1抑制剂1.5个月后死亡。原发肿瘤的分子表达谱发生多个突变(Foundation Medicine, Cambridge, MA),包括MDM2、ERBB3、ARAF、CDK4和EGFR的扩增,以及PIK3CA、FRS2、GLI1和IKZF1的突变。TMB较低,微卫星稳定。未进行免疫组化检测PD-1和PD-L1。该病例提示,MDM2扩增可作为免疫检查点抑制剂的潜在进展标志物。
(1)告知患者,接受免疫治疗的患者有权利知晓HPD可能是免疫治疗“不良反应”之一以及其可能导致的不良影响。
(2)在临床使用免疫治疗前,需要进行基因检测,评估发生HPD的风险,并在治疗过程中辅以动态监控与疗效评价(尤其是在免疫治疗开始前6~8周),密切关注患者情况(>65岁人群需格外注意)。
(3)若出现HPD症状,建议尽早考虑由免疫疗法转向抢救化疗。
专家点评
广州医科大学附属第一医院呼吸五区(肿瘤一区)主任,肿瘤中心主任助理
中华医学会呼吸分会肺癌学组委员
中国医师协会呼吸分会肺癌工作组委员
中国临床肿瘤学会(CSCO)青委会委员
广东省医学会精准医学与分子诊断分会副主委
广东省医学会呼吸病学分会肺癌学组副组长
广东省医师协会肿瘤内科分会副主委
广东省胸部疾病协会肺癌MDT分会副主委
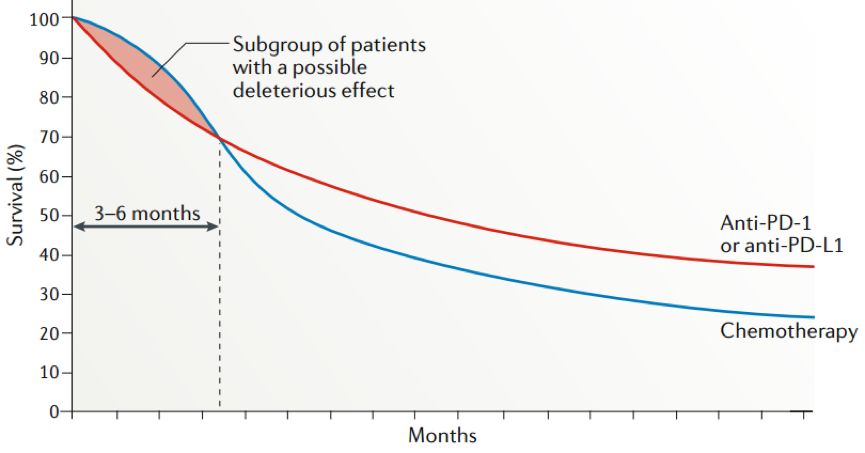
在精准医疗时代下,免疫检查点抑制剂的临床应用愈发广泛,如何提升药物有效率、降低不良反应发生率,已成为实现精准免疫的迫切需求。目前,PD-L1、肿瘤突变负荷(TMB)、错配修复缺陷/高微卫星不稳定(dMMR/MSI-H)等多种生物标志物已用于免疫药物有效人群的筛选。然而,免疫治疗后可以出现HPD,临床试验中发现,免疫治疗对部分患者不仅无效果反而有害,如临床试验[2]中看到的前期的交叉,需要后续进行大量的研究来解决该问题。
尽管HPD的发生机制并未清晰,但寻找相关预测指标同样非常重要。已有多项研究证据表明基因组改变与免疫HPD之间的关系密切。初步研究发现:MDM2/MDM4、EGFR和11q13位点上的基因如CCND1、FGF3、FGF4和FGF19等扩增与HPD可能存在相关性。在基因检测方面,与主要用于指导患者靶向用药的小panel相比,大panel基因检测如Foundationone CDx不仅可以指导患者靶向用药,还同时提供可以预测免疫治疗疗效的TMB和MSI,以及多个已知和HPD相关基因的全面检测,从而更好的助力患者更加精准的选择免疫治疗。总的来说,通过全面基因检测,结合现有证据和相关的临床因素,对患者HPD风险进行全面评估,并在治疗过程中的辅以动态监控与疗效评价,可以一定程度上更好地实现精准免疫治疗与不良反应及HPD的管理。
[1] Champiat, S. et al. Hyperprogressive disease is a new pattern of progression in cancer patients treated by anti-PD-1/PD-L1. Clin. Cancer Res,2017,23,1920–1928.
[2] Champiat S, Ferrara R, Massard C, et al. Hyperprogressive disease: recognizing a novel pattern to improve patient management. Nat Rev Clin Oncol,2018,15(12):748-762.
[3] Kamada T, Togashi Y, Tay C, et al. PD-1+ regulatory T cells amplified by PD-1 blockade promote hyperprogression of cancer.PNAS,2019, 116(20):9999-10008.
[4] Saâda-Bouzid, E. et al. Hyperprogression during anti-PD-1/PD-L1 therapy in patients with recurrent and/or metastatic head and neck squamous cell carcinoma. Ann. Oncol,2017,28,1605-1611.
[5] Ferrara R, et al. Hyperprogressive disease in patients with advanced non-small cell lung cancer treated with PD1/PD-L1 inhibitors or with single-agent chemotherapy. JAMA Oncol. 2018,4(11):1543-1552.
[6]Saada-Bouzid E, Defaucheux C, Karabajakian A, et al. Hyperprogression during anti-PD-1/PD-L1 therapy in patients with recurrent and/or metastatic head and neck squamous cell carcinoma. Ann Oncol.2017,28(7):1605-1611.
[7] Kim CG, Kim KH, Pyo KH, et al. Hyperprogressive disease during PD-1/PD-L1 blockade in patients with non-small-cell lung cancer. Ann Oncol 2019 Apr 12.
[8] Kato S, Goodman A, Walavalkar V, et al. Hyperprogressors after Immunotherapy: Analysis of Genomic Alterations Associated with Accelerated Growth Rate. Clin Cancer Res.2017,23(15):4242-4250.
[9] Singavi A, et al. Predictive biomarkers for hyper-progression (HP) in response to immune checkpoint inhibitors (ICI)—analysis of somatic alterations (SAs) [abstract 1140PD]. Annals of Oncology. 2017。
[10]Kato S, Ross JS, Gay L, et al. Analysis of MDM2 Amplification: Next-Generation Sequencing of Patients With Diverse Malignancies. JCO Precis Oncol.2018.
[11]CDKN2A/B gene loss and MDM2 alteration as a potential molecular signature for hyperprogressive disease in advanced NSCLC: A next-generation-sequencing approach. J Clin Oncol 37, 2019 (suppl; abstr e20628).