1. EGFR突变患者的靶向治疗
【1568】【Nature Reviews·Clinical Oncology】2017年肺癌研究上的巨星和绊脚石
2017年,NSCLC的治疗上一如既往的取得了很多重大进展,主要体现在分子靶向治疗和免疫治疗。在靶向治疗上,新的高效低毒的药物进入临床;免疫治疗上,免疫检查点抑制剂向更前线跨越,作为局部晚期NSCLC放化疗后的维持治疗,显著延长PFS,但在晚期NSCLC一线治疗上,免疫检查点抑制剂单药的疗效却表现各异。近日,《Nature Reviews·Clinical Oncology》特邀德国肺脏研究中心的David F. Heigener和Martin Reck教授撰文,盘点2017年肺癌领域的重磅研究。
靶向治疗和免疫治疗引领了NSCLC的治疗重大变革,在2017年,肺癌的靶向治疗和免疫治疗上,一如既往的取得了众多改变临床实践的研究进展。
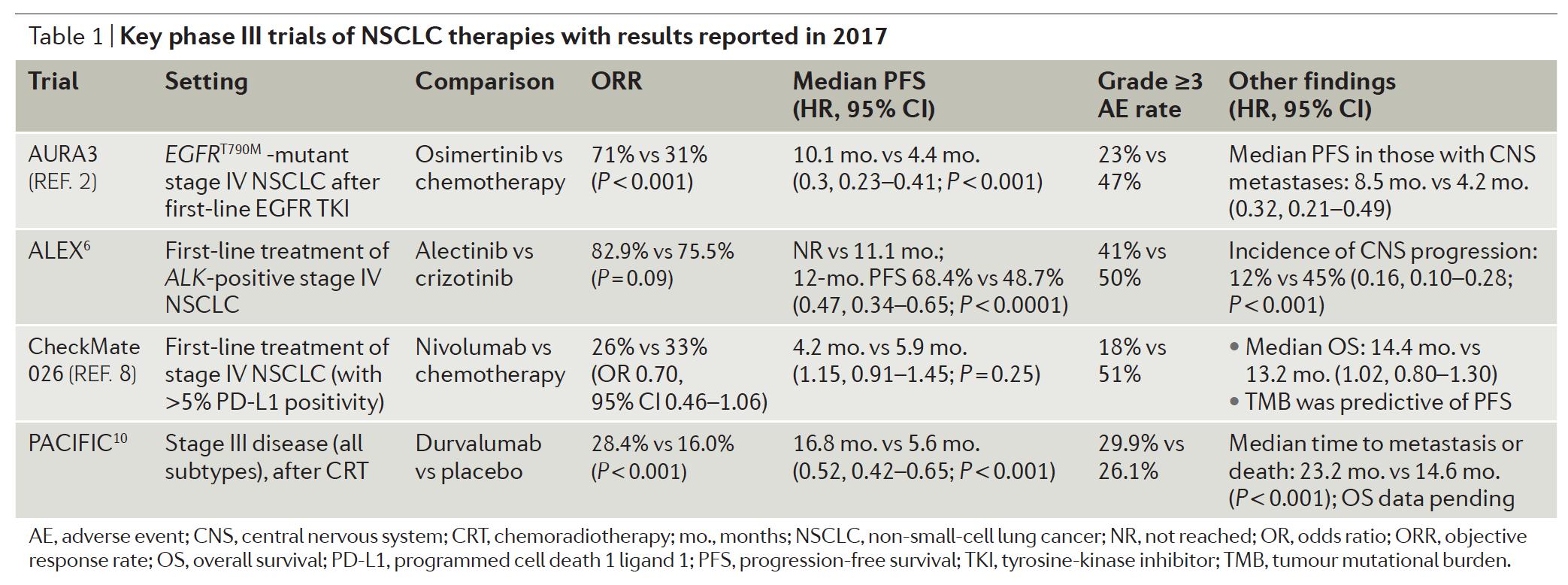
EGFR突变型晚期NSCLC患者的一线标准治疗是一代或二代EGFR TKI,然而,所有患者不可避免的会发生耐药,耐药后约50%的患者会出现EGFR T790M突变。三代EGFR TKI奥希替尼旨在克服EGFR T790M突变,选择性的作用于EGFR 敏感突变和T790M突变,对野生型EGFR几乎没有亲和力。在III期临床试验AURA3研究中,入组419例一代或二代EGFR TKI耐药后T790M突变的患者,头对头比较奥希替尼和标准的培美曲塞铂类化疗,在2017年最新报道的数据显示,奥希替尼可以显著提高ORR,延长患者的中位PFS达5.7个月(PFS为主要研究终点)。此外,在基线合并中枢神经系统转移的患者中,奥希替尼相比于化疗也可以延长PFS达4个月。更重要的是,奥希替尼相比于化疗,严重不良事件的发生率显著更低。奥希替尼成为第一个获得FDA批准的,用于一线EGFR TKI耐药后T790M突变患者的标准治疗。未来,更多关注的讨论在于:奥希替尼的最佳使用实际?
随着III期临床试验FLAURA研究的公布,这一争论更为激烈。在2017年ESMO会议上报道的FLAURA研究结果显示,奥希替尼对比标准治疗(吉非替尼或厄洛替尼)用于EGFR突变型晚期NSCLC一线治疗,可以显著延长患者的PFS(mPFS分别为18.9m vs 10.2m),3度不良事件发生率分别为34% vs 45%。
2. ALK重排患者的靶向治疗
ALK重排也是晚期NSCLC重要驱动基因之一,过去5年,克唑替尼一直推荐用于ALK阳性晚期NSCLC患者的标准一线治疗,然而,接受克唑替尼治疗的患者最终会发生耐药,一方面受克唑替尼和多耐药蛋白的亲和力(MDR1)影响,使得克唑替尼很容易泵出颅外;另一方面,ALK激酶区会出现很多获得性的耐药突变,影响克唑替尼治疗的疗效。因此,二代的ALK TKI,如alectinib(不是MDR1的作用底物),且在临床前研究中显示出对ALK耐药突变活性,用于克唑替尼耐药的患者可能会取得很好的疗效。
在III期临床试验ALEX研究中,入组303例ALK阳性的晚期NSCLC,头对头比较alcetinib和克唑替尼,在克唑替尼组和alcetinib分别中位随访17.6个月和18.6个月后,结果显示,alctinib可以显著延长患者的PFS(主要研究终点)。此外,alcetinib组和克唑替尼组发生颅内进展的患者比例分别为12% vs 45%,这也强烈支持二代ALK抑制剂有更好的CNS活性。ALEX研究和J-ALEX研究的结果,肯定了alcetinib用于ALK阳性初治患者的疗效。与EGFR突变的患者类似,后续需要进一步优化药物的使用秩序,尤其是在新药层出的时代。
3. CheckMate026研究
2016年,KEYNOTE-024研究重磅发布,结果显示,一线Pembrilizumab对比含铂双药化疗用于驱动基因野生型,PD-L1>=50%的晚期NSCLC一线治疗,可以显著改善患者的PFS(10.3个月 vs 6.0个月,P<0.001)和OS(HR=0.60,95%CI 0.41-0.89;P=0.005)。而同期报道的CheckMate026研究,入组PD-L1>=5%的患者,研究结果没有达到主要终点,noviluab的化疗组的中位PFS分别为4.2个月和5.9个月,此外,在ORR和OS上也均表现为阴性结果。进一步分析PD-L高表达亚组(PD-L1>=50%)的患者,nivolumab和化疗组仍无差异。
与KEYNOTE-024研究对比,造成CheckMate026阴性结果的可能原因包括:PD-L1表达的cut-off值,不同的检测方法,以及两个治疗组间患者基线特征的不均衡(化疗组PD-L1>50%的患者比例更高)。这两个临床研究的结果,也显示出,在新药研究上,寻找合适生物标志物来筛选入组人群的重要性。
有趣的是,在CheckMate026研究对于肿瘤突变负荷(TMB)分析上,发现了有意思的结果。在312例(58%的ITT人群)有肿瘤组织和血浆标本进行突变分析的患者中,TMB低(<100个错义突变)或中等(100-242)的患者,从nivolumab治疗中获益较少(nivolumab组mPFS分别为3.6个月和4.2个月;化疗组的mPFS分别为6.9个月和6.5个月);而TMB高(>=243)的患者,nivolumab显著提高ORR(47% vs 28%),改善PFS(9.7个月 vs 5.8个月)。此外,PD-L1的表达和TMB没有相关性。后续,需要进行前瞻性的研究去进一步明确TMB作为预测标志物的价值。
4. PACIFIC研究
在免疫治疗用于晚期NSCLC取得众多研究进展后,越来越多的研究开始关注免疫治疗用于相对早期患者的疗效。目前,对于III期NSCLC患者,标准的治疗模式为放化疗。在III期临床试验PACIFIC研究中,评估了维持免疫治疗的疗效,研究入组719例III期NSCLC患者,在同步放化疗后,2:1随机分配接受抗PD-L1单抗durvalumab或安慰剂治疗。主要研究终点为PFS和OS。目前,OS数据尚未成熟,但PFS数据显示,durvalumab显著延长患者的PFS,分别为16.8个月和5.6个月,这一研究结果是非常鼓舞人心的,但后续需要关注但终点问题是:是否有更多的患者在接受durvalumab治疗后得到治愈?还是因为疾病进展后的交叉治疗,使得两组患者的OS最终没有差异?期待OS的结果。
2017年,在NSCLC的治疗上,我们取得了重大的研究进展,尤其是靶向治疗和局部晚期NSCLC的免疫治疗。然而,免疫检查点抑制剂单药用于晚期NSCLC一线治疗上不一致的结果,是影响决定晚期NSCLC最佳治疗决策上的一个小的绊脚石。
Giant steps and stumbling blocks. Nature Reviews·Clinical Oncology,doi:10.1038/nrclinonc.2017.178 Published online 21 Nov 2017
28个肿瘤相关临床试验招募患者
点击下方图片即可查看详情