三阳性乳腺癌:机制复杂,“双管”齐下
【名家论道】朱丽教授:绝经前”三阳性”乳腺癌内分泌治疗新探索
近年来,随着分子生物学检测技术的发展,临床诊疗中经常会遇到雌激素受体 (ER)、孕激素受体(PR)及人类表皮生长因子受体2 (HER2)表达均为阳性的乳腺癌患者。这类“三阳性”的乳腺癌患者即使接受内分泌治疗或抗HER2靶向治疗,其预后仍然不甚理想,故对于这一类分型乳腺癌患者的治疗正在引起越来越多的关注与探讨。
乳腺外科副主任医师,硕士生导师
中国抗癌协会乳腺癌专业委员会委员
上海交通大学医学院附属瑞金医院乳腺疾病诊治中心
上海市抗癌协会乳腺癌专业委员会青委副主任委员
中国研究型医院乳腺专业委员会常务委员
上海市抗癌协会乳腺癌专业委员会委员
中国女医师协会乳腺疾病研究中心委员
激素受体(HR)和HER2是影响乳腺癌患者预后的两个重要生物学指标,通常两者在乳腺癌组织中不同时表达。HR阳性和HER2阳性也分别代表生物学特性、临床表现、治疗方法及预后截然不同的两类乳腺癌。因此对于“三阳性”乳腺癌患者,并不是简单的针对其中某一个靶点或者贸然的“1+1”,需要探索更多合理治疗方案的有效性和安全性。
ER和HER2介导的信号传导通路在多个环节上相互交叉,彼此影响。这种错综复杂的关系直接影响到内分泌药物以及HER2靶向药物治疗“三阳性”乳腺癌的疗效。
雌激素和ER结合,诱导ER活化,并激活下游信号传导通路,使多种蛋白激酶磷酸化,活化的ER与胞核中的一些共活化分子(如AIBl等)形成复合物,显著增加HER2转录活性,使肿瘤细胞获得生长优势;临床研究也证实了HER2阳性的乳腺癌患者,单纯内分泌治疗疗效相对较差,而ER过表达也同样影响HER2阳性的乳腺癌患者接受曲妥珠单抗治疗的疗效,因此,同时阻断上述两个通路可能会提高这部分乳腺癌患者的治疗效果。虽然2006年发表的TanDEM研究(N=207)显示,HER2阳性及ER阳性的晚期乳腺癌患者,阿那曲唑与曲妥珠单抗联合治疗的中位无疾病进展生存期(PFS)是单纯内分泌治疗的2倍,且显著延长总生存期(P=0.048),然而对于HER2阳性的乳腺癌不论其HR状态如何,目前的证据显示化疗联合靶向治疗仍然显著优于内分泌联合靶向治疗。所以对于三阳性乳腺癌患者,内分泌联合靶向治疗的地位仍有待进一步的研究证实。
肿瘤学特征看“三阳”:复发风险分级高危
对于绝经前三阳性乳腺癌患者,在选择内分泌治疗方案时,是否需要联合应用OFS是摆在临床医生面前的又一问题。
《中国抗癌协会乳腺癌诊治指南与规范(2017)》中提到淋巴结转移1-3枚且HER2阳性乳腺癌患者的术后复发风险高。无论是NCCN指南还是ASCO指南均推荐较高危患者应当接受含OFS的内分泌治疗;《中国早期乳腺癌卵巢功能抑制临床专家共识(2016)》也提到,对于绝经前高危患者推荐内分泌联合OFS治疗。因此,我们可以认为,绝经前三阳性乳腺癌患者应该接受以OFS为基础的内分泌治疗方案。
绝经前“三阳”:“双管齐下”+ OFS并肩战斗
TanDEM等临床研究证实了内分泌联合靶向药物对于”三阳性”MBC的有效性,那么,对于绝经前EBC患者,在靶向联合化疗的基础上是否需要进一步强化内分泌治疗呢?
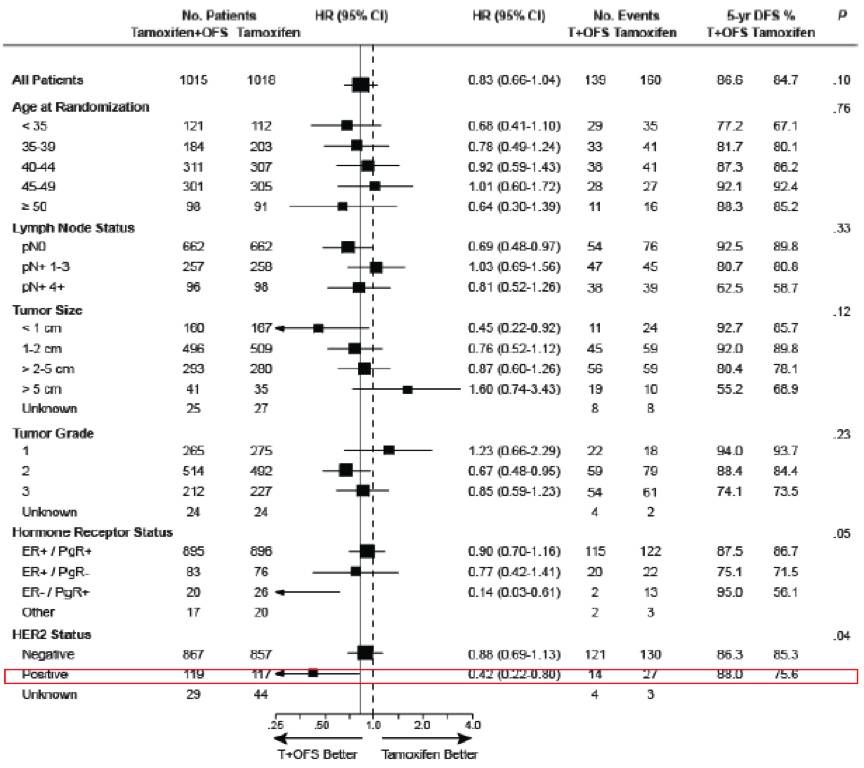
SOFT研究结果显示:该研究人群中有236例HER2阳性、HR阳性的乳腺癌患者,亚组分析显示,TAM+OFS组(n=117)5年无疾病生存率 (DFS) 达88%,较TAM组(n=119)显著降低了58%的复发风险(HR=0.42,95%CI:0.22-0.80);该研究还分析了既接受内分泌同时也接受了抗HER2靶向治疗的141例亚组人群(140例接受了化疗),TAM+OFS组(n=73)DFS相较于TAM组(n=68)亦有显著获益(HR=0.61,95%CI:0.39-0.95)。而在另外100例HR阳性HER2阳性没有接受靶向治疗患者中, TAM+OFS组(n=53)与TAM组(n=47)的DFS无明显差别(HR=1.14,95%CI:0.71-1.83)。
上述数据显示对于绝经前“三阳性”乳腺癌患者,抗HER2靶向治疗是必需的,而在使用了靶向治疗的情况下,OFS联合内分泌治疗获益更为显著。
图1.SOFT研究:DFS亚组风险(中位随访67个月)
综上所述,不论是国内外指南还是各种循证证据,都提示我们,对于绝经前“三阳性”乳腺癌患者,临床上可能需要做更多的“加法”,需要更强效的内分泌治疗方案,以实现临床获益的最大化。同时,我们也希望能够开展更多不同方案的临床研究,来实现对这部分患者的个体化治疗的探索,从而为广大乳腺癌患者争取更美好的明天。