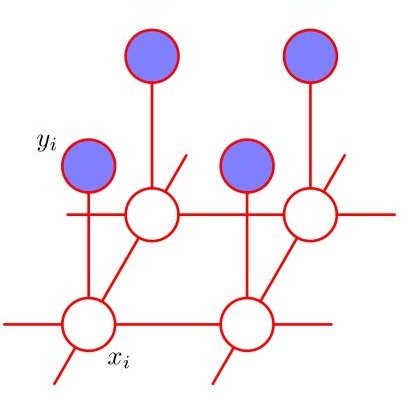
Precision cancer medicine aims to determine the optimal treatment for each patient. In-vitro cancer drug sensitivity screens combined with multi-omics characterization of the cancer cells have become an important tool to achieve this aim. Analyzing such pharmacogenomic studies requires flexible and efficient joint statistical models for associating drug sensitivity with high-dimensional multi-omics data. We propose a multivariate Bayesian structured variable selection model for sparse identification of omics features associated with multiple correlated drug responses. Since many anti-cancer drugs are designed for specific molecular targets, our approach makes use of known structure between responses and predictors, e.g. molecular pathways and related omics features targeted by specific drugs, via a Markov random field (MRF) prior for the latent indicator variables of the coefficients in sparse seemingly unrelated regression. The structure information included in the MRF prior can improve the model performance, i.e. variable selection and response prediction, compared to other common priors. In addition, we employ random effects to capture heterogeneity between cancer types in a pan-cancer setting. The proposed approach is validated by simulation studies and applied to the Genomics of Drug Sensitivity in Cancer data, which includes pharmacological profiling and multi-omics characterization of a large set of heterogeneous cell lines.
翻译:精密癌症医学旨在确定每个病人的最佳治疗方法; 体外癌症药物敏感性筛查,加上癌症细胞的多组特征鉴定,已成为实现这一目标的一个重要工具; 分析这种药理学研究需要灵活而高效的联合统计模型,将药物敏感性与高维多组特征数据联系起来; 我们提议一个多种变量的贝叶斯结构化变量选择模型,用于分散识别与多重相关药物反应有关的动漫特征; 由于许多抗癌药物是为特定分子目标设计的,我们的方法利用了反应和预测器之间的已知结构,例如分子路径和特定药物所针对的相关血管特征,在稀疏的、看起来无关的回归中,先用马尔科夫随机字段(MRF)进行。 我们提出的结构信息可以改善模型性能,即变量选择和反应预测,与其他常见的以前相比。 此外,我们采用随机效应,在泛扫描器设置中收集癌症类型之间的异异性,例如分子路径和特定药物针对特定药物的预测线。 拟议的方法,先是马科夫随机的随机外线(MRF),先用模拟研究,然后通过大规模化学定序分析系统进行。