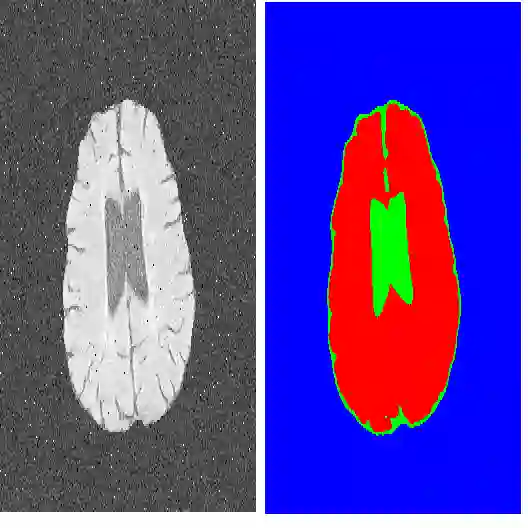
Domain adaptation (DA) has drawn high interest for its capacity to adapt a model trained on labeled source data to perform well on unlabeled or weakly labeled target data from a different domain. Most common DA techniques require concurrent access to the input images of both the source and target domains. However, in practice, privacy concerns often impede the availability of source images in the adaptation phase. This is a very frequent DA scenario in medical imaging, where, for instance, the source and target images could come from different clinical sites. We introduce a source-free domain adaptation for image segmentation. Our formulation is based on minimizing a label-free entropy loss defined over target-domain data, which we further guide with a domain-invariant prior on the segmentation regions. Many priors can be derived from anatomical information. Here, a class ratio prior is estimated from anatomical knowledge and integrated in the form of a Kullback Leibler (KL) divergence in our overall loss function. Furthermore, we motivate our overall loss with an interesting link to maximizing the mutual information between the target images and their label predictions. We show the effectiveness of our prior aware entropy minimization in a variety of domain-adaptation scenarios, with different modalities and applications, including spine, prostate, and cardiac segmentation. Our method yields comparable results to several state of the art adaptation techniques, despite having access to much less information, as the source images are entirely absent in our adaptation phase. Our straightforward adaptation strategy uses only one network, contrary to popular adversarial techniques, which are not applicable to a source-free DA setting. Our framework can be readily used in a breadth of segmentation problems, and our code is publicly available: https://github.com/mathilde-b/SFDA
翻译:域适应( DA) 已经吸引了人们对它的能力的高度兴趣, 即它是否有能力调整一个在标签源数据上经过培训的模型, 以便很好地利用不同域的未贴标签或标签薄弱的目标数据。 多数常见的 DA 技术要求同时访问源和目标域的输入图像。 但是, 实际上, 隐私问题常常妨碍在适应阶段提供源图像。 这是医学成像中一种非常常见的DA假想, 例如, 源和目标图像可能来自不同的临床网站。 我们引入了一个无源直径域对图像偏移的图像。 我们的制成基于尽可能减少目标图像和标定目标域域数据定义的无标签纹损失, 这些数据在分割区域之前,我们进一步以域变异变量为指南。 这里, 类比比率是根据解剖知识来估算的, 以Kellback Leebter (KL) 格式整合我们整体损失功能的差异。 此外, 我们的总体损失是以一种有趣的链接, 在目标图像及其标签预测中, 我们进一步定义的免标签损失损失, 我们进一步指导, 之前的域变换的系统应用方法, 我们的模型应用了我们之前的变现的变型的变型的变型的变型系统, 我们的变型的变型方法, 的变型的变式的变式的变式的变式的变式的变式的变式的变式, 我们的变式的变式的变式的变式, 我们的变式, 我们的变式的变式的变式的变式的变式的变式的变式的变式的变式的变式, 我们的变式的变式的变式的变式的变式的变式的变式的变式的变式的变式的变式的变式方法, 我们的变式的变式的变式的变式的变式, 的变式, 的变式的变式的变式的变式的变式的变式的变式的变式的变式的变式, 我们的变式的变式的变式的变式的变式的变式, 我们的变式的变式的变式的变式的变式的变式的变式的变式的变式的变式的变式的变式的