苏州大学:包封在功能性多肽水凝胶中的间充质干细胞外泌体促进心脏修复
干细胞来源的外泌体是心血管疾病的潜在疗法,然而体内移植后外泌体的低保留率仍然是临床应用中的主要挑战。来自苏州大学附属第一医院李杨欣课题组的研究人员在Biomaterials Science(IF=5.831)杂志上发表文章,他们利用功能性多肽水凝胶包封人脐带间充质干细胞来源的外泌体,从而增加外泌体在体内的保留率和稳定性,改善大鼠心肌梗塞模型中的心脏功能。
缺血性心脏病(Ischemic heart diseases)是世界范围内疾病死亡的主要原因之一。由于成人心肌细胞属于非增殖性质的终末分化细胞,不会发生有丝分裂,受损的心肌通常被纤维化的瘢痕组织取代,最终会导致心力衰竭。研究表明,间充质干细胞、胚胎干细胞、造血干细胞或诱导多能干细胞等不同类型干细胞来源的外泌体具有心脏保护作用。与干细胞相比,外泌体表现出与其来源细胞类似的有益效果。重要的是,外泌体不会引发宿主的免疫反应,从而避免与干细胞移植相关的免疫排斥风险。外泌体的治疗产生有益效果的分子机制较多,包括促进血管生成和抑制细胞凋亡和纤维化等。因此,基于外泌体的疗法已经成为在心肌梗死后恢复心脏功能的最有希望的策略之一。
然而基于外泌体的治疗目前存在着一些困难,比如,注射到体内的外泌体在体内会被快速清除。研究表明,在心肌注射3小时后,外泌体就无法被检测到了。通过使用诸如水凝胶的生物材料可以克服这个问题,这是因为这些生物材料可以形成与组织内的细胞外基质类似的微环境,保护外泌体免受清除。事实上,水凝胶已被广泛用作生物载体用于递送功能性分子、药物或外泌体,用于促进伤口愈合等。然而,水凝胶形成时的孔径相对较大,因此需要进一步对水凝胶进行改性以获得更好的保留率。
基于肽的自组装水凝胶形成孔径较小,具有呈递表位的能力,并且肽链可以自由设计满足特定需求。肽两亲物(peptide amphiphile ,PA)是由与肽序列偶联的疏水烷基尾部组成,并在去离子水中形成具有反平行β-折叠结构的双层水凝胶。通过对肽序列进行设计,可以设计成促进细胞粘附表型或者促水凝胶降解。最关键的是,自组装肽水凝胶具有非免疫原性和相对小的孔径,适合携带和包裹药物和疫苗。
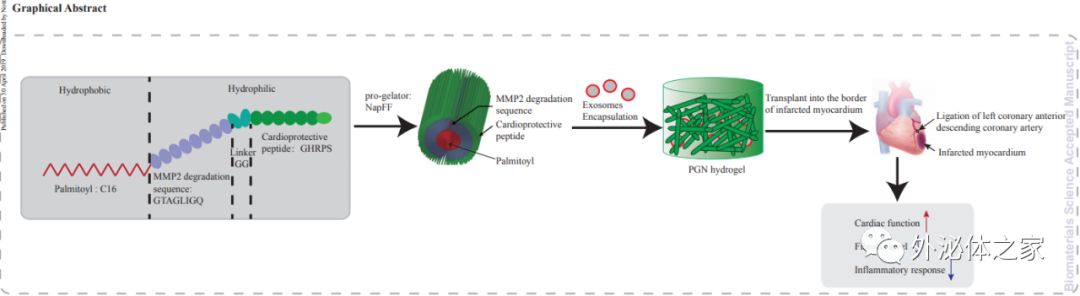
在本研究中,研究人员采用了一种新型可注射的自组装PA,用于递送干细胞。研究人员加入了心脏保护肽(GHRPS,His-DTrp-Ala-Trp-DPhe-Lys-NH2)和基质金属蛋白酶-2(MMP-2)可降解序列Gly-Thr-Ala-Gly-Leu-Ile-Gly-Gln(GTAGLIGQ)到PA中从而制备出PA-GHRPS。 MMP-2可降解序列能够使水凝胶降解,确保包封的外泌体和GHRPS肽释放到周围组织中。 GHRPS属于生长激素释放肽的成员,可以激活促存活途径并抑制炎症和纤维化。NapFF是一种自组装肽两亲化合物,由与苯丙氨酸二肽的N末端偶联的萘乙酰基尾组成,具有很强的自组装能力,可形成水凝胶。因此,研究人员旨在确定PA-GHRPS的凝胶形成能力,并确定这种功能性多肽水凝胶是否可以延长外泌体在体外的存活时间,从而改善心肌梗塞后的心脏功能。
结果表明,PA-GHRPS肽能够保护H9C2细胞免受H2O2诱导的氧化应激。NapFF可以增强PA-GHRPS的凝胶能力。研究人员将这两种肽混合制备出PGN水凝胶,用于包封外泌体。数据显示,PGN水凝胶能够有效地包封外泌体并确保外泌体的稳定性和持续释放。将外泌体-PGN水凝胶混合物注入大鼠心脏的梗塞边界区,与单独的外泌体处理相比,该混合物通过减少炎症、纤维化和细胞凋亡并促进血管生成来改善心肌功能。因此,本研究提供了一种实用且有效的方法利用外泌体在心肌再生中实现应用。
【科研成长加油站】
2019年中国肿瘤标志物学术大会暨第十三届肿瘤标志物青年科学家论坛
系统评价与meta分析学习班和临床科研设计和数据管理学习班( Meta班:6/27-30;上海临床管理班:7/2-4)
肿瘤免疫课题设计、前沿技术、文章写作、基金申请培训班 解析肿瘤免疫,一手全掌握(6/29-30 上海)
肠道菌与代谢课题设计(含国自然)与研究方法专题培训班(6/22-23 上海)
不做实验,不写meta,用这个方法轻轻松松发SCI论文(7/6-7 广州)
回复“外泌体” 阅读外泌体最新科研进展及动态
回复“EV” 阅读 2016-2018年This Week in Extracellular Vesicles
回复“盘点” 阅读 外泌体领域十大前沿进展盘点