Nature 子刊:线粒体在细胞内的定位改变促进肿瘤转移?阻断线粒体运动过程抑制肿瘤迁移同时增加ROS的杀伤力
肿瘤细胞在转移和迁移过程中,细胞中的线粒体的亚细胞定位也会发生改变,但是具体机制并不清楚。近日,来自日本北海道大学的研究团队在Nature Communications杂志发现,肿瘤侵袭相关通路Arf6-AMAP1途径促进线粒体的运动和迁移,并抑制了ROS对肿瘤的杀伤作用。该研究结果确定了细胞运动和线粒体动力学之间的新关联方式。
肿瘤细胞的迁移是一个复杂的过程,需要细胞内许多生物化学和细胞生物学过程的参与。在不同类型的细胞迁移中观察到线粒体向特定亚细胞位点的动态重新定位,而在白细胞趋化过程中线粒体在尾足上集中,在成纤维细胞和癌细胞的迁移和侵袭中观察到线粒体向细胞边缘的重新分布。虽然线粒体的生物能量作用已被认为在细胞运动中至关重要,但线粒体动力学如何与细胞运动协调以及这种线粒体重新定位的生物学意义的潜在机制仍有待完全阐明。
有充分证据表明,活性氧(ROS)主要通过线粒体呼吸链二产生,与癌细胞的恶性特性密切相关,包括侵袭和转移过程。另一方面,癌细胞通常也通过上调抗氧化酶和细胞代谢的重编程显示出强大的抗氧化能力,抵抗ROS对癌细胞的杀伤。许多抗癌治疗,包括电离辐射(IR),直接或间接地增加细胞内ROS的产生,被证明有助于杀伤癌细胞。因此,癌细胞对ROS的高耐受性与癌症治疗的抗性密切相关,并且其调节被认为是癌症治疗的有希望的策略。
肿瘤细胞的治疗抗性和侵袭性经常同时被观察到,因此被认为是相互关联的。整合素(Integrins)在细胞运动的调节中具有主要作用,包括肿瘤侵袭,而它们还通过激活下游信号促进对包括IR在内的治疗抗性。虽然整合素介导的肿瘤信号已被证明可以促进其对IR治疗的抵抗以及IR后其侵袭性的增强,这个过程可能通过调节线粒体参与调节细胞内ROS水平的功能和线粒体定位。
研究表明,在肿瘤中经常过表达的小GTP酶Arf6及其效应物AMAP1通过影响整合素的定位在肿瘤侵袭、转移和耐药性方面具有至关重要的作用。 Arf6和AMAP1的表达水平与肿瘤细胞的侵袭活性高度相关,并且这两个蛋白促进癌症侵袭期间内化的β1-整合素再循环回质膜。在这个过程中,Arf6-AMAP1途径通过蛋白激酶D2(PRKD2)直接结合β1整合素的细胞内部分。PRKD2的表达水平在肿瘤细胞中没有明显变化,因此不是Arf6-AMAP1-PRKD2通路的决定因素,但表皮生长因子受体(EGFR)信号传导可激活另一种小GTP酶Rab5c作为AMAP1-PRKD2相互作用的正调节因子。同时,EGFR还通过GTP交换因子GEP100 / BRAG223激活Arf6,这对于通过其Arf GAP结构域将AMAP1与Arf6结合起来至关重要。另一方面,Arf6-AMAP1途径也可能通过某些未知机制促进肾癌和乳腺癌细胞的耐药性。尽管Arf6-AMAP1-PRKD2途径在肿瘤侵袭中的重要作用已经如上所述,但该途径如何影响细胞应激,如何通过调节整合素功能和ROS调节来影响耐药性,仍然很大程度上未知。
在这项研究中,研究人员发现Arf6-AMAP1途径在控制线粒体定位中起关键作用,这对于阻止高侵袭性乳腺癌细胞中的ROS失活和细胞侵袭至关重要。阻断该途径增加细胞内ROS水平并诱导微管组织中心附近的线粒体聚集。由线粒体聚集引起的线粒体密集网络中观察到ROS增加,其类似于ROS诱导的心肌细胞的ROS释放(RIRR)。 Arf6-AMAP1途径是整合素连接激酶(ILK)有效定位于粘着斑(FAs)所必需的,调节由运动衔接因子RhoT和TRAK介导的线粒体运输。 RhoT-TRAK介导的线粒体动力学调控在高侵袭性乳腺癌细胞中非常普遍,并且抑制线粒体迁移、降低肿瘤细胞侵袭性并增加细胞内ROS水平。类似RIRR的ROS增加显著增强了稳定状态和ROS通过激活caspase-3诱导ROS后细胞死亡,而DNA损伤和修复基本上没有受到影响。这些发现表明细胞迁移和线粒体动力学之间存在新的分子联系,这对于高侵袭性肿瘤的侵袭活性和对ROS的耐受性都是至关重要的。研究结果也提出了新的策略,以提高类似IR等ROS介导的癌症治疗的功效。
结果:
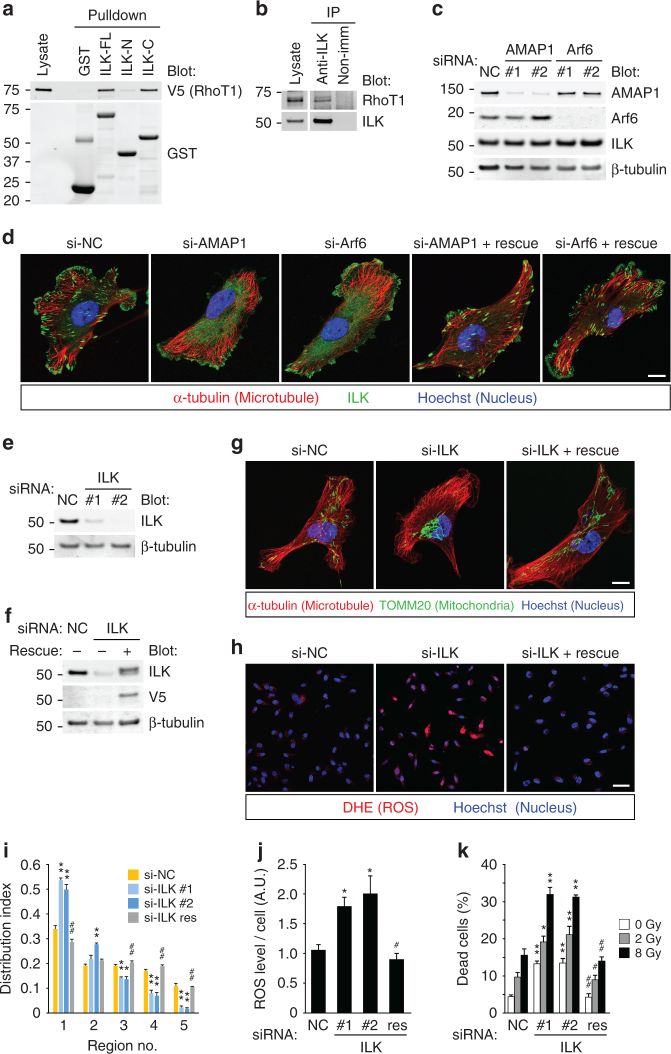
1. Arf6-AMAP1细胞侵袭信号通过能够重编程线粒体分布和ROS水平。
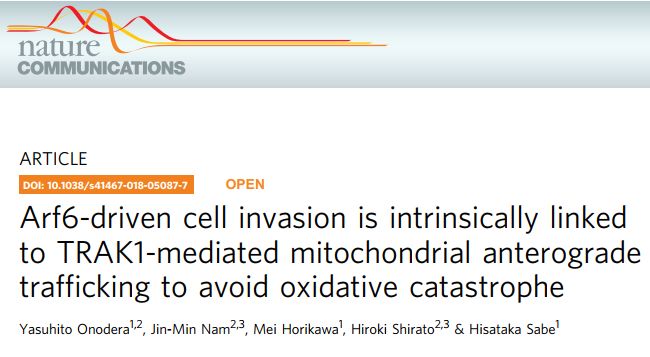
A.B 用siRNA敲低Arf6-AMAP1信号通路增加了ROS(红色信号)的产生。
C.D 用siRNA敲低Arf6-AMAP1信号通路增加ROS水平并促进细胞死亡,使用EUK134(过氧化氢酶类似物)后抑制ROS水平。
E.F. 用siRNA阻断Arf6-AMAP1通路明显增加了位于细胞质(e)和线粒体(f)中的roGFP2的氧化反应。
G. H.I. 用siRNA阻断Arf6-AMAP1通路抑制了线粒体(绿色)向细胞周围的分布,促进聚集,并通过数学模型进行了量化。
J.K. 但是,用siRNA阻断Arf6-AMAP1通路后,线粒体内的DNA量以及线粒体的呼吸量OCR值均未受到影响,表明Arf6-AMAP1信号对ROS的调节不是通过影响线粒体本身实现,而是影响的线粒体的迁移。
2. 线粒体在乳腺癌细胞内的聚集,增加了ROS的产生。
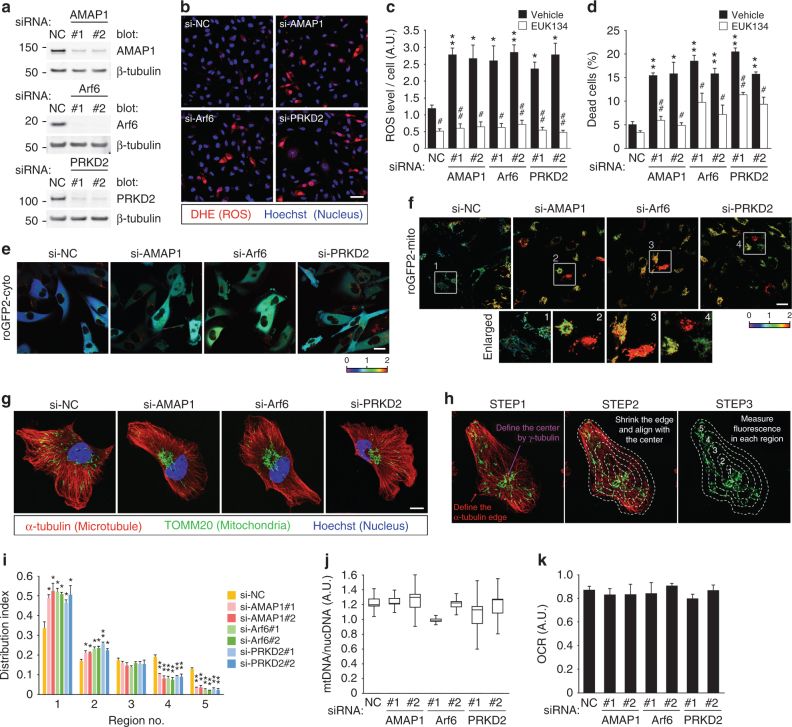
A. 线粒体(红色信号)稀疏(Sparse)和密集(Dense)状态下,ROS(H2O2,绿色信号)的量分别显示较少和较多。
B. 线粒体稀疏(Sparse)和密集(Dense)状态下,ROS的产生量随时间的增加情况(线粒体密集时ROS增加多)。
C. D. 研究人员开发了一个系统,将MTS-FKBP和BICD2N-FRB*分别锚定在线粒体膜上,用雷帕霉素类似物(Rapalog)可以诱导这二者的结合,使线粒体(绿色)聚集。
E.F.Rapalog诱导线粒体聚集后,ROS信号(红色)增强。
3. 线粒体聚集通过ROS增加,增强电离辐射诱导的细胞死亡。
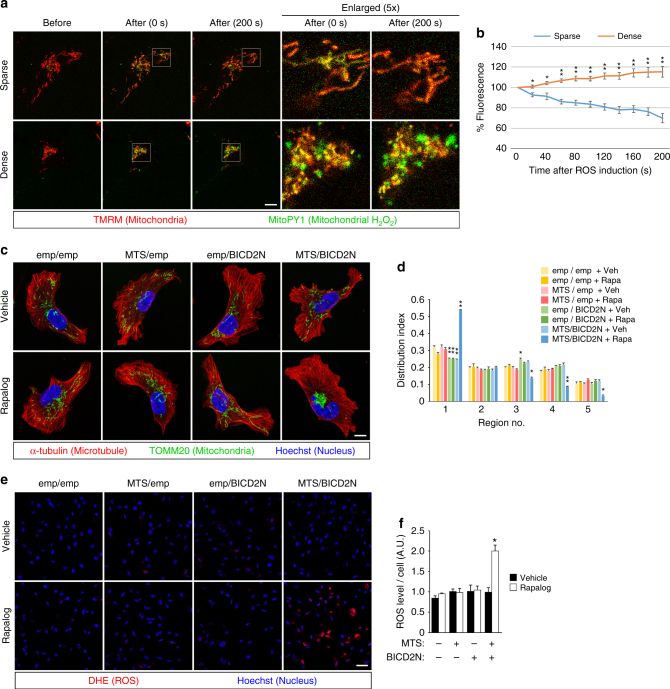
A. 用siRNA抑制Arf6-AMAP1通路,增加了电离辐射对乳腺癌细胞的敏感性。
B. 而消除细胞内ROS后,细胞对电离辐射敏感性降低。
C. 雷帕霉素类似物(Rapalog)诱导线粒体聚集后,细胞对电离辐射敏感性增加。
D.E. 但是用H2O2处理细胞使细胞ROS增加,但是H2O2处理并不增加细胞对电离辐射的敏感性,表明电离辐射本身带来的ROS增加不会影响细胞的放疗敏感性。
F. siRNA抑制Arf6和AMAP1,增加了Caspase3的活化,电离辐射后,Caspase3的活化程度增加。
G. 泛Caspase抑制剂Z-VAD-FMK处理后,Arf6-AMAP1通路对电离辐射敏感性的影响降低。这些结果表明线粒体聚集引起ROS增加,是通过活化Caspase3凋亡途径实现细胞死亡。
4. 整合素连接激酶(ILK)在粘着斑(FAs)上的定位调节线粒体在细胞内的分布。
A. RhoT1和RhoT2与ILK47结合介导整合素信号转导。蛋白质相互作用实验证实ILK通过其含有激酶结构域的C末端部分与RhoT1结合。
B. 内源co-IP证明ILK与RhoT1相互作用。
C. D. 抑制Arf6-AMAP1通路并不改变ILK蛋白表达,改变的是ILK在粘着斑(FAs)上的分布。
E-K 用siRNA抑制ILK后(E-F),诱导线粒体的聚集(G I)以及ROS的产生(H J K)。
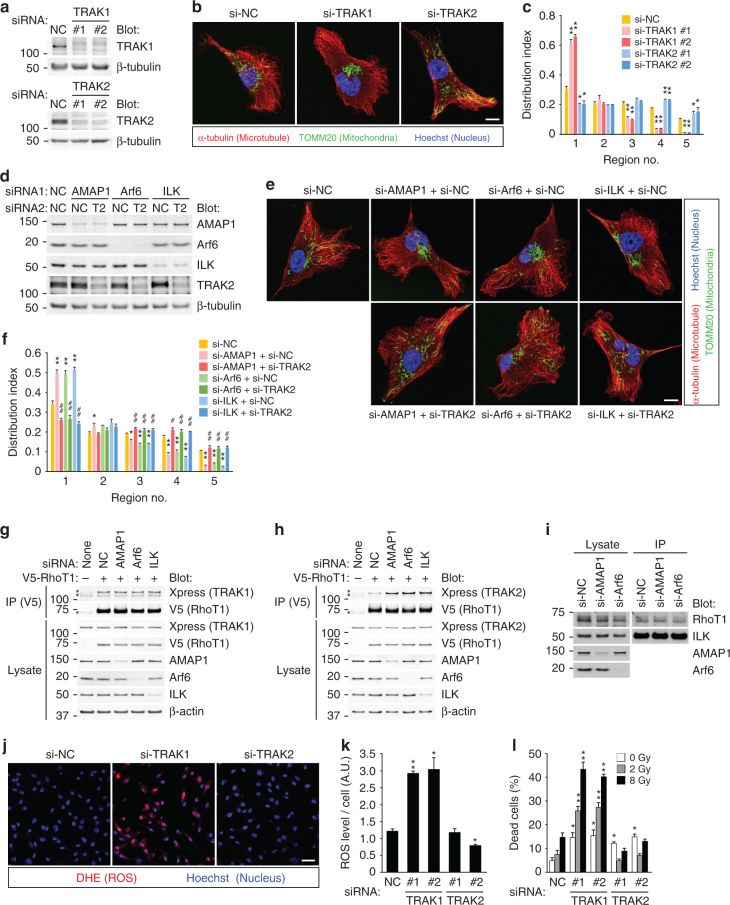
5. Arf6-AMAP1途径通过ILK抑制RhoT1-TRAK2相互作用从而重新分布线粒体。
A-C.RhoT通过衔接蛋白家族TRAK/Milton实现与微管的连接。敲低TRAK1后线粒体聚集,而敲低TRAK2后线粒体则向细胞周围分布。表明TRAK1和TRAK2在乳腺癌细胞中的作用是线粒体的顺向和逆向运送线粒体。
D-F. AMAP1、Arf6或ILK的敲低诱导线粒体的聚集以及ROS的增加,但是敲除TRAK2后这些现象会消失。
G. H. 敲除AMAP1、Arf6或ILK后,RhoT1与TRAK2的结合能力明显增加,但是不影响RhoT1与TRAK1的结合。
I. 敲除AMAP1、Arf6后,不影响ILK和RhoT1的结合。
J. K. 敲除TRAK1后,ROS明显增加;而TRAK2的敲除不影响ROS。
I. TRAK2敲低后细胞死亡增加,但在接受电离辐射后之后并没有增加敏感性,也就是说TRAK2对线粒体以及细胞死亡的调节与ROS直接影响无关。
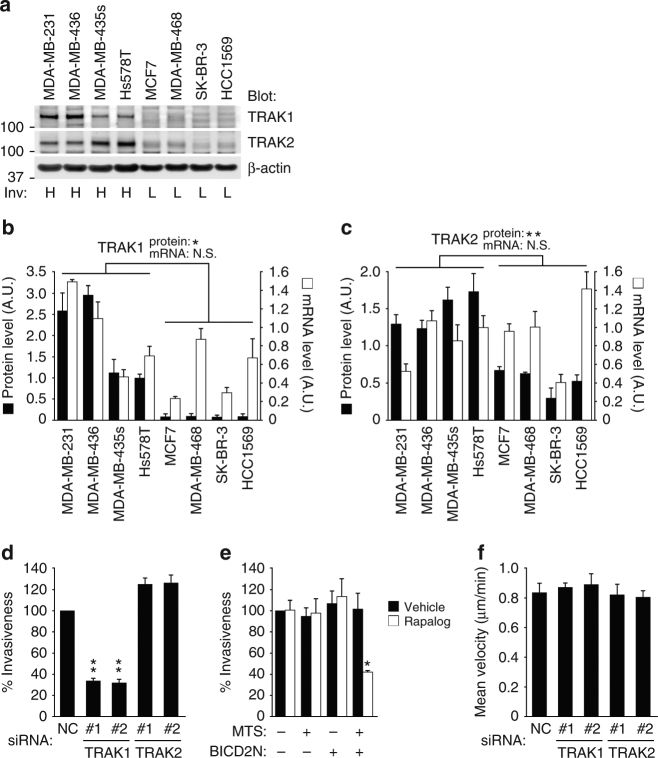
6. TRAK1通过控制线粒体运输促进肿瘤细胞侵袭。
A. 高侵袭性的乳腺癌细胞(标注H)中的TRAK1和TRAK2的蛋白质表达水平更高。
B. C. 但是TRAK1和TRAK2的mRNA水平在高低侵袭性乳腺癌细胞中水平差距不大。
D. 敲低TRAK1明显降低了MD-MB-231细胞的侵袭性,但是TRAK2不会。
E. Rapalog诱导的线粒体向中央聚集,也降低了细胞的侵袭性。
F. 但是TRAK1和TRAK2均不会影响细胞在胶原蛋白表面的随机迁移速度。这些结果表明,TRAK1介导的线粒体顺向运输有助于肿瘤细胞侵袭。
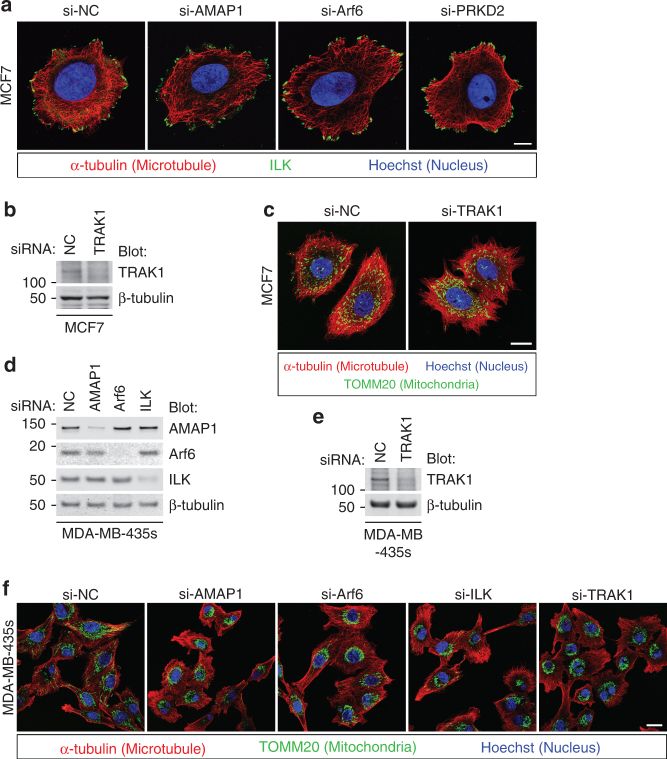
7. ILK-RhoT-TRAK途径调节高侵袭性乳腺癌细胞中的线粒体重新分布。
A. 抑制Arf6-AMAP1通路,ILK蛋白趋向MDA-MB-231细胞质的外围分布。
B. C. 在侵袭性较弱的MCF7细胞中,抑制TRAK1不影响MCF7的线粒体分布。
D-F 浸润性、侵袭性强的乳腺癌细胞系MDA-MB-435中,AMAP1、Arf6、ILK或TRAK1的敲低显著抑制线粒体的细胞质外围分布,趋向于中心聚集。
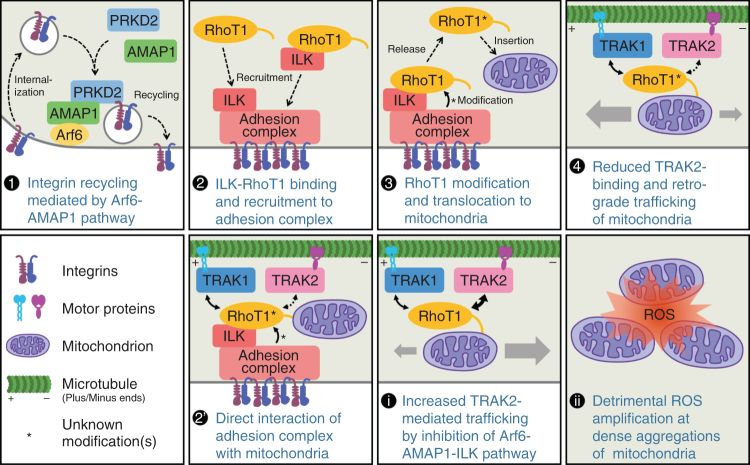
8. 由Arf6-AMAP1-ILK途径调节的线粒体分布的示意图。
侵袭性肿瘤细胞中Arf6-AMAP1途径介导的整合素循环对于成熟粘合斑FA的形成是必需的(1)。在FAs(2)处形成或募集的ILK-RhoT1复合物可能与粘附复合物的一些其他组分相互作用,这导致RhoT1的分子特性的改变。修饰的RhoT1被释放出来并嵌入线粒体外膜(3),并负向调节RhoT1和TRAK2之间的相互作用,导致线粒体的顺向运输相对增加(4)。另一种可能性是锚定在线粒体外膜上的RhoT1可能与ILK相互作用,ILK弥散于细胞质中,当线粒体之间相互靠近聚集时,可能发生上述修饰(2')。这些机制的破坏降低了侵袭性并增强了RhoT1和TRAK2之间的分子相互作用,RhoT1和TRAK2优先介导线粒体逆行运输(i)。由此引起的线粒体聚集导致ROS扩增(ii)。
科研学习班了解一下~ ~(点击详细了解):
回复“外泌体” 阅读外泌体最新科研进展及动态
回复“EV” 阅读 2016-2018年This Week in Extracellular Vesicles
回复“盘点” 阅读 外泌体领域十大前沿进展盘点