将温室气体变废为宝:新的光敏蛋白让CO2无处逃遁 | Nat Chem论文推荐
人类对能源的需求日益增大,化石燃料的过度消耗带来了严峻的环境污染和能源危机,而将太阳能这一清洁能源转化为化学能,已经成了化学和生物学研究领域的重点问题。在 11 月 5 日发表于《自然·化学》(Nature Chemistry)上的最新究中,华人科学家王江云带领的团队设计了一种可以基因编码的光敏蛋白质,成功模拟了天然光合作用系统吸收光能、催化二氧化碳还原的功能。
图片来源:CC0 Creative Commons
撰文 王江云课题组
编辑 令狐鸭
在化石燃料日趋耗竭的情况下,太阳能这种清洁无害、来源丰富的能源已成为人类能源使用的重要部分。中国科学院院长、中科院院士白春礼等曾在《焦耳》(Joule)上发文,提出在化石燃料枯竭的未来,“液态阳光”(liquid sunshine)可能是解决问题的关键。
而实现液态阳光的关键在于利用丰富的太阳能,将能源利用过程中产生的过量排放的二氧化碳重新循环转化为稳定、可存储、高能量的化学物质。植物的光合作用系统是一种天然的能源解决方案,它具有清洁、自组装、可持续和高效的光致电荷分离效率等优势,受到了科研界的广泛关注。在这一方向上,目前的研究热点是:如何利用和模拟光合作用的高光合效率来驱动具有挑战性的化学转化。
图片来源:nbcnews.com
现阶段该领域发展的技术挑战及研究难点在于:天然光合作用系统是由复杂的膜蛋白亚基和多种辅酶组成的,这给研究和应用带来了不便;光合系统中会产生还原分子 NAD(P)H,但这种分子的还原性较差,不能直接用于还原 CO2;相比化学小分子催化剂,天然光合作用系统具有较低的 CO2 还原效率。
为解决这些问题,王江云团队在开发基因编码的人工光合作用系统这一方面一直潜心研究,应用合成生物学方法使其兼具天然光系统和化学小分子催化剂的优势。这种人工设计的光合蛋白质不仅为研究太阳能的化学转化提供了新思路,也为具有非天然光催化活性的人工生命体提供了研究基础。
在前期研究中,王江云团队发现:仅有约 27kD 的荧光蛋白可能被改造为类似天然光系统的光合蛋白质。荧光蛋白受光激发后,其发色团可以生成具有高还原活性的物种,这种中间体可以高效地向位于蛋白质 beta 折叠桶外的电子受体传递电子;另一方面,应用基因密码子扩展技术,可以特异性地插入非天然氨基酸取代原组成发色团的酪氨酸。
这使得研究人员可以按照意愿设计荧光蛋白的发色团化学结构,优化其吸收光谱、激发态寿命、自由基还原电势等一系列光化学性质。(Angew. Chem. Intl. Ed. 2012, 51, 10261-5;Angew. Chem. Intl. Ed. 2013, 52, 4805-9;J. Am. Chem. Soc. 2014, 136 , 13094-7;J. Am. Chem. Soc., 2015,137,7270-3)
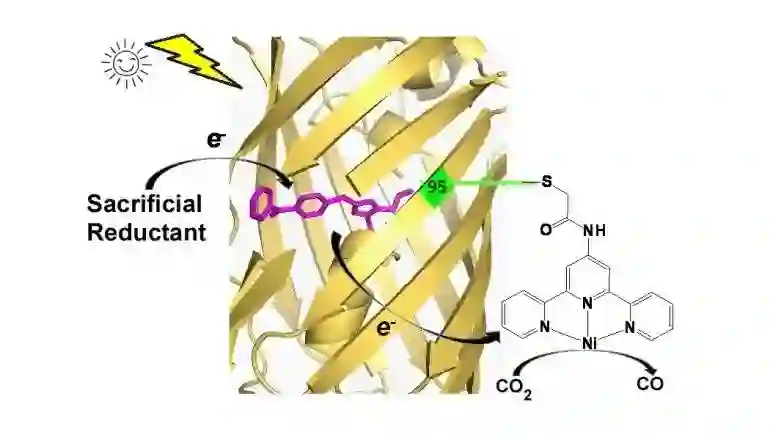
这种基于荧光蛋白突变体的高效 CO2 光还原蛋白质,设计起来的核心问题在于如何延长在发色团受激发后生成的还原性中间态的寿命,降低它的还原电势。在这项新的研究中,研究团队选择了一种带有二苯甲酮取代基的酪氨酸类似物(BpA)来改造发色团。
二苯甲酮是一种有机光催化中常用的光敏剂,当它受到一定波长的光照射时,其激发态以近 100% 的效率系间穿越为寿命较长的三重态,进而和牺牲还原剂反应,生成高活性的自由基态,催化下游氧化还原反应。基于密码子扩展的方法,在插入BpA 改造荧光蛋白的发色团后,新生成的光敏蛋白(PSP)保留了这种特性。
催化机制示意图
瞬态吸收光谱的研究表明,受光激发后,BpA 组成的新发色团可以几乎全部转化为三重态;在和生物相关牺牲还原剂的存在下,三重态中间体快速氧化牺牲还原剂,从而生成自由基态。该自由基被蛋白质骨架保护,因此在没有氧气存在的条件下也可以稳定存在 10 分钟以上。
晶体结构衍射则显示,PSP 处于自由基状态时,其发色团呈现出更加扩展的共平面构象,这与紫外-可见吸收光谱检测得到的红移吸收结果一致。
另一方面,合成的含有 BpA 发色团小分子的电化学分析表明,所生成的自由基态具有接近 -1.5V 的还原电势。这不仅满足了还原 CO2 的需求,也低于已知的天然生物还原剂。
在获得了该光敏蛋白后,研究人员进一步应用化学生物学方法,在 PSP 蛋白表面特定位点引入了一种三联吡啶镍配合物,这是一种小分子 CO2 电化学还原催化剂。这种杂合蛋白质能够在光照条件下将 CO2 还原成 CO,光量子产率为 2.6%,高于大部分已报道的 CO2光还原催化剂,也就是说基于蛋白质自组装特性,带来了电子传递的优化和活性的提高。
这种光敏蛋白催化剂具有多种优势:无重金属;较易引入各种生物体;通过合理的设计或定向进化有显著的扩展能力。因此,PSP 具有光敏化多种化学转化的潜能,涉及的领域也非常多样,例如太阳能转化、光生物学、环境修复和工业生物学等。
本文来自微信公众号“科研圈”。如需转载,请在“科研圈”后台回复“转载”,或通过公众号菜单与我们取得联系。
论文信息
标题 A genetically encoded photosensitizer protein facilitates the rational design of a miniature photocatalytic CO2-reducing enzyme
作者 Xiaohong Liu, Fuying Kang, Cheng Hu, Li Wang, Zhen Xu, Dandan Zheng, Weimin Gong, Yi Lu, Yanhe Ma & Jiangyun Wang
期刊 Nature Chemistry
摘要 Photosensitizers, which harness light energy to upgrade weak reductants to strong reductants, are pivotal components of the natural and artificial photosynthesis machineries. However, it has proved difficult to enhance and expand their functions through genetic engineering. Here we report a genetically encoded, 27 kDa photosensitizer protein (PSP), which facilitates the rational design of miniature photocatalytic CO2-reducing enzymes. Visible light drives PSP efficiently into a long-lived triplet excited state (PSP*), which reacts rapidly with reduced nicotinamide adenine dinucleotide to generate a super-reducing radical (PSP•), which is strong enough to reduce many CO2-reducing catalysts. We determined the three-dimensional structure of PSP• at 1.8 Å resolution by X-ray crystallography. Genetic engineering enabled the site-specific attachment of a nickel–terpyridine complex and the modular optimization of the photochemical properties of PSP, the chromophore/catalytic centre distance and the catalytic centre microenvironment, which culminated in a miniature photocatalytic CO2-reducing enzyme that has a CO2/CO conversion quantum efficiency of 2.6%.
阅读论文解读及推荐
点击👉关注领研网论文频道。
▽ 精彩回顾 ▽