Science子刊:中科院科学家找到癌症免疫耐受新方法!
2018年诺贝尔生理学或医学奖花落癌症免疫疗法的先驱者美国James P Allison教授和本庶佑教授。其获奖原因是发现了免疫检查点抑制疗法(ICB)。近几年,使用PD-L1的免疫检查点抑制疗法在临床应用上大放异彩。免疫检查点抗体药物能够激活部分肿瘤患者的免疫效应,显著延长肿瘤患者生存期。
不幸的是,ICB治疗对大多数肿瘤患者的响应率比较低,只有小部分接受治疗的患者对目前的ICB治疗有反应(其占比低于30%)。其中一个重要原因便是肿瘤组织内细胞毒性T淋巴细胞(CTLs)浸润程度低导致免疫耐受。同时,免疫检查点抗体药物易造成非肿瘤靶向分布(on-target but off-tumor),从而引发严重的免疫相关毒副作用。因此,开发一种切实可行的策略来对抗这种免疫耐受和扩大ICB治疗已成为当务之急。
为了迎接这一挑战,中国科学院上海药物研究所(SIMM)的科学家们开发了一种用于癌症免疫治疗的肿瘤微环境活化抗体纳米颗粒。这项研究发表在《Science Immunology》网络版上。
DOI: 10.1126/sciimmunol.aau6584
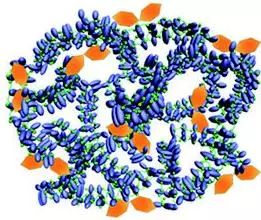
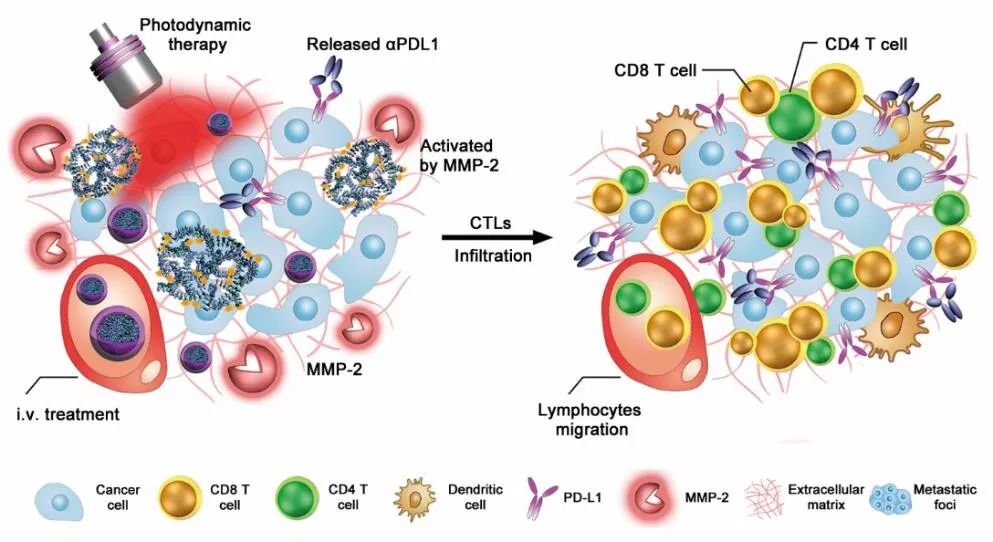
中国科学院上海药物研究所研究员于海军和李亚平合作开发了肿瘤微环境激活型免疫检查点抗体药物递送系统。这种抗体药物递送系统通过整合anti-PD-L1抗体(αPDL1)和吲哚菁绿(ICG)形成粒径约为150 nm的纳米颗粒。ICG已经取得临床获批可用于活体手术荧光成像。抗体纳米颗粒可在血液中稳定循环,同时避免αPDL1与正常组织PD-L1结合,一旦在肿瘤部位累积便被激活以释放αPDL1,用于肿瘤特异性PD-L1阻断。
携带PD-L1抗体(蓝色)和光敏剂(绿色)的活化纳米颗粒的图示
同时,抗体纳米颗粒在肿瘤微环境中会触发肿瘤抗原的释放,促进肿瘤内CTLs的浸润。在808 nm波长近红外光照射下,ICG光敏剂可发挥光动力效应,生成活性氧诱导肿瘤部位炎症反应,提高肿瘤免疫原性,促进细胞毒性T淋巴细胞瘤内浸润。
该研究的共同通讯作者余教授解释说:“这对癌症免疫治疗至关重要,因为CTL已被充分确认为肿瘤细胞的杀手。”
研究人员发现抗体纳米颗粒不仅能有效提高患乳腺癌小鼠的抗肿瘤免疫功能,还能诱导小鼠的长期免疫记忆效应,从而导致肿瘤显著消退。此外,体内抗肿瘤实验和相关免疫机制研究表明,基于抗体纳米颗粒的抗体药物递送策略可有效消除三阴性乳腺癌的免疫耐受,抑制乳腺癌原位瘤生长和肺转移。
该研究工作进一步揭示了肿瘤免疫耐受对肿瘤免疫检查点疗法的负向调控作用,为有效改善肿瘤免疫检查点疗法提供了新的解决方案。
余教授说:“我们提供了一个强大的抗体纳米平台,启动抗肿瘤免疫和抑制免疫检查点,这可以很容易地适应其他免疫检查点抑制剂增强ICB治疗。鉴于纳米结构的简单性,我们的研究有可能转化为未来几代癌症免疫治疗。”
End
参考资料:
[1] Elegant antibody nanoparticles override immunological tolerance of tumors
[2] Engineering nanoparticles to locally activate T cells in the tumor microenvironment
[3] 上海药物所构建免疫检查点抗体药物递送系统
本文系生物探索原创,欢迎个人转发分享。其他任何媒体、网站如需转载,须在正文前注明来源生物探索。