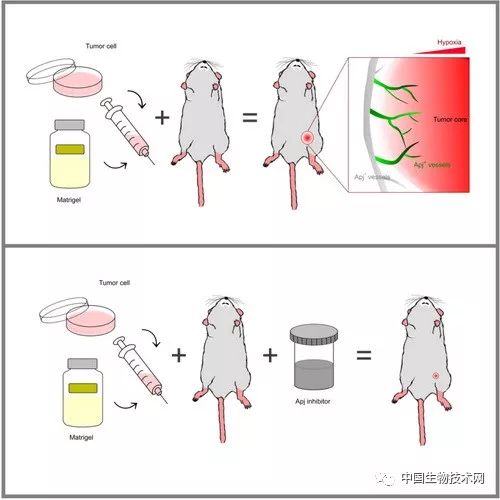
研究发现肿瘤血管新生的新分子标记Apj
近日,国际学术期刊 在线发表了中国科学院生物化学与细胞生物学研究所周斌研究组的科研成果“Apj+ vessels drive tumor growth and represent a tractable therapeutic target”。该研究利用在Apj-CreER和Apj-DTRGFP-Luc基因转入小鼠体内分别建立皮下肿瘤移植模型、原位肿瘤移植模型、基因缺陷原位肿瘤模型和化合物诱导肿瘤模型,追踪Apj的表达情况,发现Apj可以特异性地标记大部分的肿瘤新生血管。该研究进一步揭示肿瘤恶性增殖与血管新生的关系,进而加深对肿瘤疾病的认识,同时也为靶向肿瘤新生血管的药物研发提供更加坚实的理论基础。
由于现代社会环境污染加剧,人口老龄化,社会生活压力大等,恶性肿瘤的发病率呈现出一个逐年上升的趋势,对人类生命健康和生活幸福构成了很大威胁,因此,对于肿瘤的预防与治疗依然是近些年来医学生物领域亟待解决的热点与焦点课题。肿瘤血管靶向治疗是近些年提出的一种新型肿瘤治疗方案,指的是以肿瘤产生的血管系统作为治疗靶点,主要包括抑制肿瘤血管新生和阻断肿瘤血管内血液流动两大类,相对现有的肿瘤治疗方法(外科疗法、放疗、化疗等)而言,该方法具有明确的靶点,可以抑制肿瘤恶性增殖而不会对周围正常组织器官产生伤害,比较安全可靠。但目前即将和已经应用于临床的抗肿瘤血管新生的抑制剂(比如靶向VEGF的小分子化合物、酪氨酸激酶抑制剂、MMP抑制剂等)在不同疾病与不同体质的患者中仍有一定的治疗风险(比如肾衰竭、高血压和血栓等),因此,继续寻找和研发特异性靶向肿瘤新生血管的药物具有重要意义。
在该项研究中,研究人员构建了特异性靶向新生血管受体的工具小鼠Apj-CreER和Apj-DTRGFP-Luc,然后在成体Apj-CreER;Rosa-GFP小鼠体内构建皮下肿瘤移植模型、原位肿瘤移植模型、基因缺陷原位肿瘤模型和化合物诱导肿瘤模型,并在特定时间点灌胃他莫昔芬,利用遗传谱系示踪技术追踪Apj的表达情况,发现Apj可以特异性地标记大部分的肿瘤新生血管而不标记其他健康成体器官中的血管。接着研究人员利用一系列体外实验和Apj-CreER;Rosa-GFP;Flk1 fl/fl小鼠发现Apj在肿瘤血管中上调主要受到缺氧因子的诱导和VEGF信号通路调控。然后研究人员在建立皮下肿瘤移植模型之后,利用三种方法(对Apj-CreER;Rosa-GFP/DTA小鼠灌胃他莫昔芬诱导“死亡基因”表达;Apj-DTRGFP-Luc小鼠注射DT;Apj受体抑制剂)特异性地抑制或清除Apj阳性的细胞,一定时间后收集肿瘤和各器官,发现可以显著抑制血管新生和肿瘤增殖。该工作进一步揭示了肿瘤血管新生和恶性增殖的关系,为肿瘤疾病治疗等提供了一个新的研究靶点。
该项工作在研究员周斌指导下,由研究生赵欢等完成,并得到牛津大学教授Nicola Smart、上海科技大学教授徐斐研、北京大学教授白凡、生化与细胞所研究员程新等的大力支持,同时得到中科院、国家基金委、国家科技部、上海市科委等的经费资助。
文章来源:生物化学与细胞生物学研究所
中国生物技术网诚邀生物领域科学家在我们的平台上,发表和介绍国内外原创的科研成果。
注:国内为原创研究成果或评论、综述,国际为在线发表一个月内的最新成果或综述,字数500字以上,并请提供至少一张图片。投稿者,请将文章发送至weixin@im.ac.cn。
本公众号由中国科学院微生物研究所信息中心承办
微信公众号:中国生物技术网 回复关键词“热点”可阅读热点专题文章,包括“施一公”、“肠道菌群”、“肿瘤”、“免疫”和“健康”