2019 WCLC | NSCLC一线治疗进展:双免疫联合治疗在晚期NSCLC 安全性探索
今年第20届IASLC世界肺癌大会(World Conference on Lung Cancer,WCLC)于9月7—10日在西班牙巴塞罗那举行,该会议是世界上最大的致力于肺癌和其他胸部恶性肿瘤的学术活动,也是唯一一个致力于肺癌研究的全球性组织,此次会议的主题是“Conquering Thoracic Cancers Worldwide”。会议上肿瘤免疫治疗持续大放光彩,除长期生存数据再次证明其持续应答长期获益的优势外,肿瘤免疫联合治疗的疗效和安全性数据也在不断更新,双免疫联合更成为此次会议热点。精彩内容【肿瘤资讯】带您一睹为快!
近年来免疫治疗带起了一场肿瘤治疗的新兴革命,在非小细胞肺癌(NSCLC)、黑色素瘤、消化道肿瘤等多个瘤种均有建树。在非小细胞肺癌领域,接受免疫二线治疗的晚期患者有15%左右可获得长期生存获益,较化疗有了明显提高, 从而可将这部分患者转为类似慢性疾病治疗。目前,国内外各大指南已明确PD-1/PD-L1抑制剂单药治疗在NSCLC二线治疗的首选地位。
同时,免疫治疗也在NSCLC一线领域展开积极探索,目前主要分为免疫单药治疗和免疫联合治疗两个研究方向。免疫单药治疗方面,已有一些经典研究如KEYNOET-024研究、KEYNOTE-042研究、CheckMate 026研究从不同角度验证了IO单药一线治疗在高度选择人群(PD-L1≥50%/TMB High)中的获益。而在免疫联合治疗方面,多个研究正在进行,如免疫联合不同化疗药物,免疫联合抗血管生成药物以及双免疫联合等。这些研究面临的挑战例如在如何进一步扩大获益人群,如何充分发挥免疫治疗深度持久的应答优势,以及不同免疫联合治疗的安全性如何等问题以及应对思路,成为临床关注的研究热点。此次WCLC大会更新了双免疫联合CheckMate 817研究的安全性数据,借此机会,我们来回顾一下双免疫联合治疗晚期NSCLC在安全性上的探索。
WCLC双免疫联合治疗安全性数据最新更新
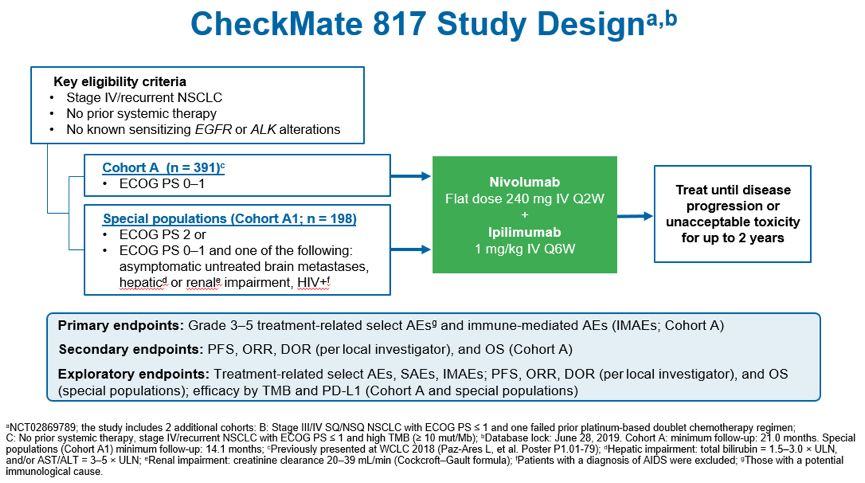
此次WCLC 大会上,Fabrice Barlesi教授汇报了NSCLC 双免疫联合治疗 CheckMate 817 研究最新安全性数据。CheckMate 817研究主要观察两组既往未接受过治疗的晚期NSCLC患者(队列A和队列A1)。队列A纳入了391名ECOG PS 0~1的患者,队列A1则由198名ECOG PS评分为2或ECOG PS 评分0~1但合并无症状的未治疗脑转移,肝或肾功能损伤或HIV感染者组成的特殊患者(AOSP),两组均排除EGFR突变或对可用靶向治疗敏感的ALK易位的患者。每组均接受纳武利尤单抗固定剂量(240mg,每2周静脉注射1次)联合基于公斤体重计算的低剂量的Ipilimumab(1mg/kg,每6周静脉注射1次),使用至2年或直至患者出现疾病进展或不可耐受的毒性。主要研究终点为队列A3~5级治疗相关不良事件(TRAE)和免疫相关不良事件(irAE);次要终点为基于当地研究者分析的PFS、ORR、DOR和队列A的OS。研究同时还设立了探索性研究终点:基于当地研究者分析的治疗相关不良事件、严重不良事件、免疫相关不良事件;PFS、ORR、DOR和特殊人群的OS;队列A和特殊人群基于TMB和PD-L1的疗效分析。
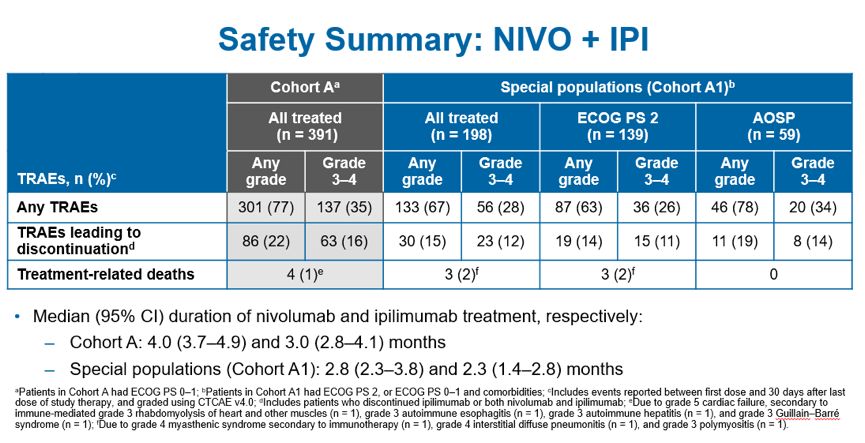
队列A主要研究结果曾在2018年AACR上有报道,固定剂量纳武利尤单抗(240mg,每2周静脉注射1次)联合基于体重的低剂量Ipilimumab(1mg/kg ,每6周静脉注射1次)与既往根据体重计算纳武利尤单抗(3mg/kg,每2周静脉注射1次)的研究中观察到的疗效和安全性是一致的。此次大会主要公布A1队列ECOG PS 2或 AOSP的患者数据分析。ECOG PS 2是指能够进行所有自我护理但无法进行任何工作,并且日间起床活动时间超过一半的患者,AOSP组主要纳入的是合并无症状的未治疗脑转移,肝或肾功能损伤或HIV感染者组成的特殊患者, 大多数III期临床试验中这两类患者均排除在外。A1队列仍是使用纳武利尤单抗固定剂量(240mg,每2周静脉注射1次)联合基于体重低剂量Ipilimumab(1mg/kg,每6周静脉注射1次)治疗晚期NSCLC。研究结果显示,不良事件发生率为67%,3~4级不良事件发生率为28%,主要表现为皮肤毒性、内分泌毒性、消化道毒性、肝毒性、肺毒性、过敏/输液反应以及肾毒性。因治疗相关不良事件导致停止治疗的患者比率仅为15%,其中3~4级治疗相关不良事件引起停止治疗的比例为12%。由治疗相关不良事件导致的死亡发生率极低,仅为3例(2%),分别为4级免疫治疗继发性肌无力综合征1例、4级间质弥漫性肺炎1例和3级多发性肌炎1例。与A组既往发表的数据相比,固定剂量纳武利尤单抗联合基于体重低剂量Ipilimumab的双免疫联合方案在一般人群、ECOG PS 0~1人群(A组)和ECOG PS 2或合并特殊疾病的特殊人群(A1组)中均观察到一致的安全性。
同时研究还公布了A1组疗效数据,A1组双免疫联合治疗在特殊人群中表现出令人鼓舞的结果。如之前预期,尽管疗效总体结果受到ECOG PS 2或者合并症的影响,但患者通过双免疫治疗仍获得了持久的应答。此外研究中还显示高TMB(≥10 mut/Mb)和高PD-L1表达(≥1%或≥50%)与两组PFS延长有关。
免疫相关不良反应(irAE)的特点
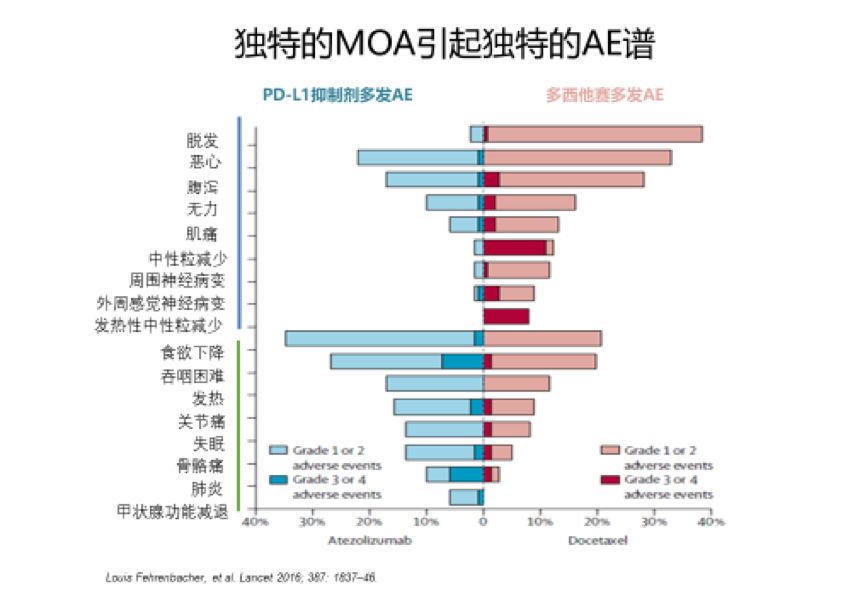
目前双免疫联合治疗主要指的是CTLA-4抗体联合PD-(L)1抗体治疗方案。自国际上从2011年CTLA-4单抗获批应用于临床,以及2015年PD-1抑制剂首次获批应用于非小细胞肺癌以及黑色素瘤以来,已有大量IO单药治疗的安全数据发表。与化疗的细胞毒性作用机制不同,免疫检查点抑制剂的应用由于可降低对免疫系统的抑制作用,上调抗肿瘤免疫应答,在解除免疫抑制作用的同时也强化了对自身抗原的免疫应答,从而导致免疫相关不良反应的发生(irAE)。临床试验中报道多为单药应用免疫检查点抑制剂的安全性数据,与化疗的骨髓抑制、恶心、脱发和神经病变等常见不良反应不同,相对常见的irAE主要集中在胃肠道、肝、内分泌、肺和皮肤;神经系统、心脏、肾等部位的毒性较为罕见。除肺毒性外,常见irAE整体发生率低于化疗,多为1~2级, 3~4级发生率较低(<5%~10%)且致死率罕见(0.36%~1.23%),大多数irAE可以通过暂停给药或联合皮质类固醇激素得以控制并且可以逆转。目前可以看到,PD-1/PD-L1抑制剂单药治疗安全性明显优于化疗;且已有数据显示,CTLA-4抑制剂Ipilimumab的毒性与剂量有相关性,低剂量(1mg/kg,每6周注射1次)的Ipilimumab较高剂量(3mg/kg ,每3周注射1次)的Ipilimumab安全性更好。
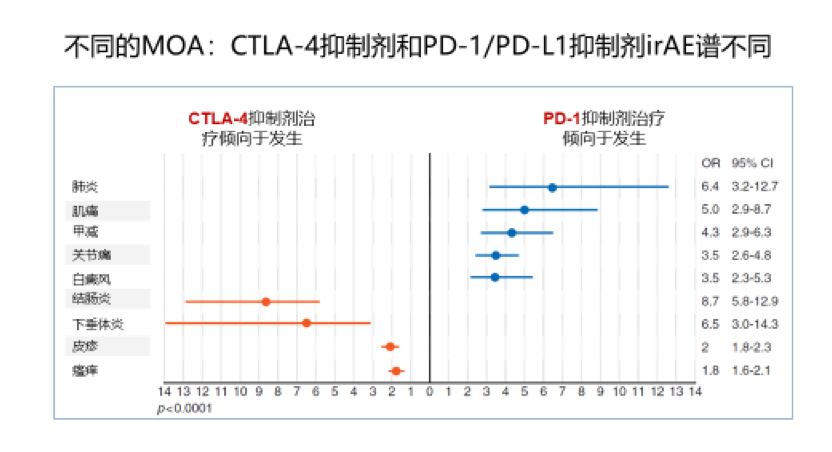
CTLA-4抗体和PD-1抗体同为免疫检查点抑制剂,但由于它们的作用通路和时间不同,其观察到其免疫治疗相关毒性谱也略有不同。2017年发表的ESMO指南免疫治疗相关毒性管理中提到,基于在转移性黑色素瘤患者中的纳武利尤单抗联合较高剂量Ipilimumab(3mg/kg,每3周注射1次)治疗数据,观察到CTLA-4抗体和PD-1抗体双免疫联合治疗3~4级的毒副反应较免疫单药治疗可能发生的更早,而且发生的时间跨度会更大。
小结
综上,在免疫治疗出现以前,晚期肺癌药物治疗一直以化疗为主导。化疗虽然是一种重要的抗癌手段,但其临床不良反应也让患者依从性和生活质量受到极大的影响。在尽可能减少化疗在非小细胞肺癌一线治疗使用的道路上,免疫单药(PD-1/PD-L1)或双免疫联合治疗(PD-1/PD-L1+CTLA-4 )在安全性和疗效做出了不断探索。免疫单药治疗已有大量数据证实其安全性明显优于化疗,而在双免疫联合治疗方面,也有研究陆续证实其安全性。此次WCLC 大会上更新的CheckMate 817研究的安全性数据,就再次证实了双免疫联合治疗方案在NSCLC的一线治疗与既往一致的安全性。
1. Wolchock et al, J Clin Oncol 2013 ASCO Annual Meeting Abstracts 31:15_suppl.;
2. YERVOY [prescribing information]. Princeton, NJ: Bristol-Myers Squibb; 2015;
3. OPDIVO [prescribing information]. Princeton, NJ: Bristol-Myers Squibb; Cell. 2017 Aug 9.
4. Ann Oncol. 2017 Jul 1;28(suppl_4):iv119-iv142.;
5. Nat Rev Clin Oncol. 2016 Aug;13(8):473-86.
6. Ann Oncol. 2017 Oct 1;28(10):2377-2385.
* Ipilimumab 尚未在中国大陆上市