科研人员实现光控药物胞浆递送和肿瘤的可视化治疗
细胞毒性T细胞具有特异性杀伤异常细胞的能力,在肿瘤治疗中发挥着重要作用。嵌合抗原受体-T细胞(CAR-T)的发明进一步拓宽了其在肿瘤治疗领域的应用。然而,细胞毒性T细胞在体内的行为难以监测和调控,在实体瘤治疗中由于免疫微环境的存在疗效有限,且需要从患者提取T细胞进行修饰,规模化制备受限。
中国科学院上海药物研究所制剂研究中心研究生翟艺慧在副研究员张鹏程和研究员李亚平的指导下,采用天然来源的明胶和红细胞膜构建了包载水溶性药物亚甲基蓝和顺铂的仿细胞毒性T细胞纳米粒(MPV),实现了纳米粒的实时示踪、光控激活和胞浆药物递送,发现 MPV 能够在血液中长循环,并可利用 MPV 内高浓度亚甲基蓝的光声特性实现肿瘤内药物蓄积的实时监测;在肿瘤蓄积最高时,通过红外激光照射可在肿瘤部位利用 MPV 的光热/光动力特性,提高 MPV 在肿瘤内的渗透并触发其向肿瘤细胞胞浆递送亚甲基蓝和顺铂,并利用光热成像和荧光成像实时观测肿瘤内 MPV 的激活过程和程度;随后在光动力和化疗联合作用下,促使肿瘤细胞凋亡,使原位三阴性乳腺癌肿瘤部分消退并抑制其97%肺转移灶的形成。这一研究工作提出了构建可视化实时监控纳米药物治疗肿瘤的新策略,揭示了其仿细胞毒性T细胞的作用机理,为有效治疗转移性三阴性乳腺癌提供了新思路。
该研究工作于7月10日发表在国际期刊《先进材料》(Advanced Materials)上,该项目获得国家基金委创新群体科学基金和面上项目等的支持。
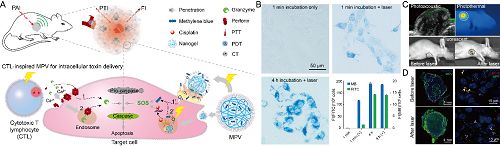
仿细胞毒性T细胞策略构建纳米载体工作原理示意图(A),该仿生纳米载体可在光照下直接将药物递送入细胞浆(B),该过程可在动物水平通过光声、光热和荧光成像实时监测(C),并在组织水平通过共聚焦显微镜证实其肿瘤渗透和胞浆分布(D)
来源:中国科学院上海药物研究所
登录查看更多
相关内容
Arxiv
4+阅读 · 2018年4月19日
Arxiv
4+阅读 · 2018年4月2日
Arxiv
13+阅读 · 2018年1月25日