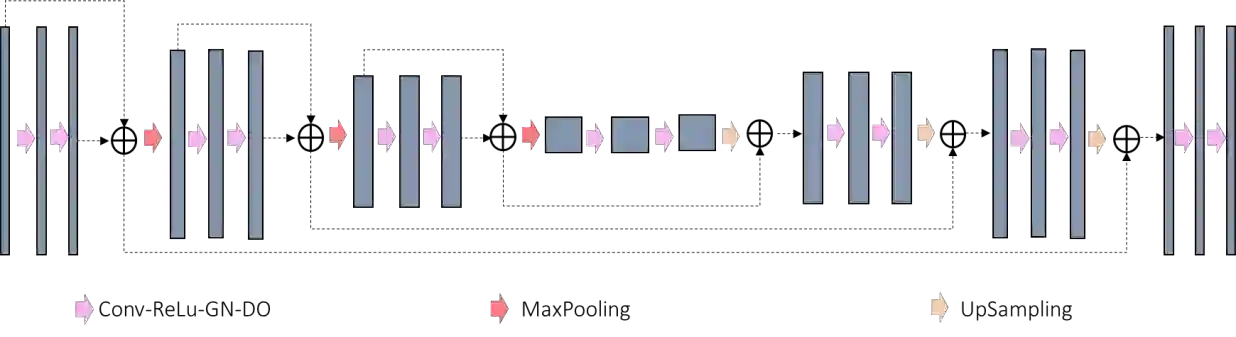
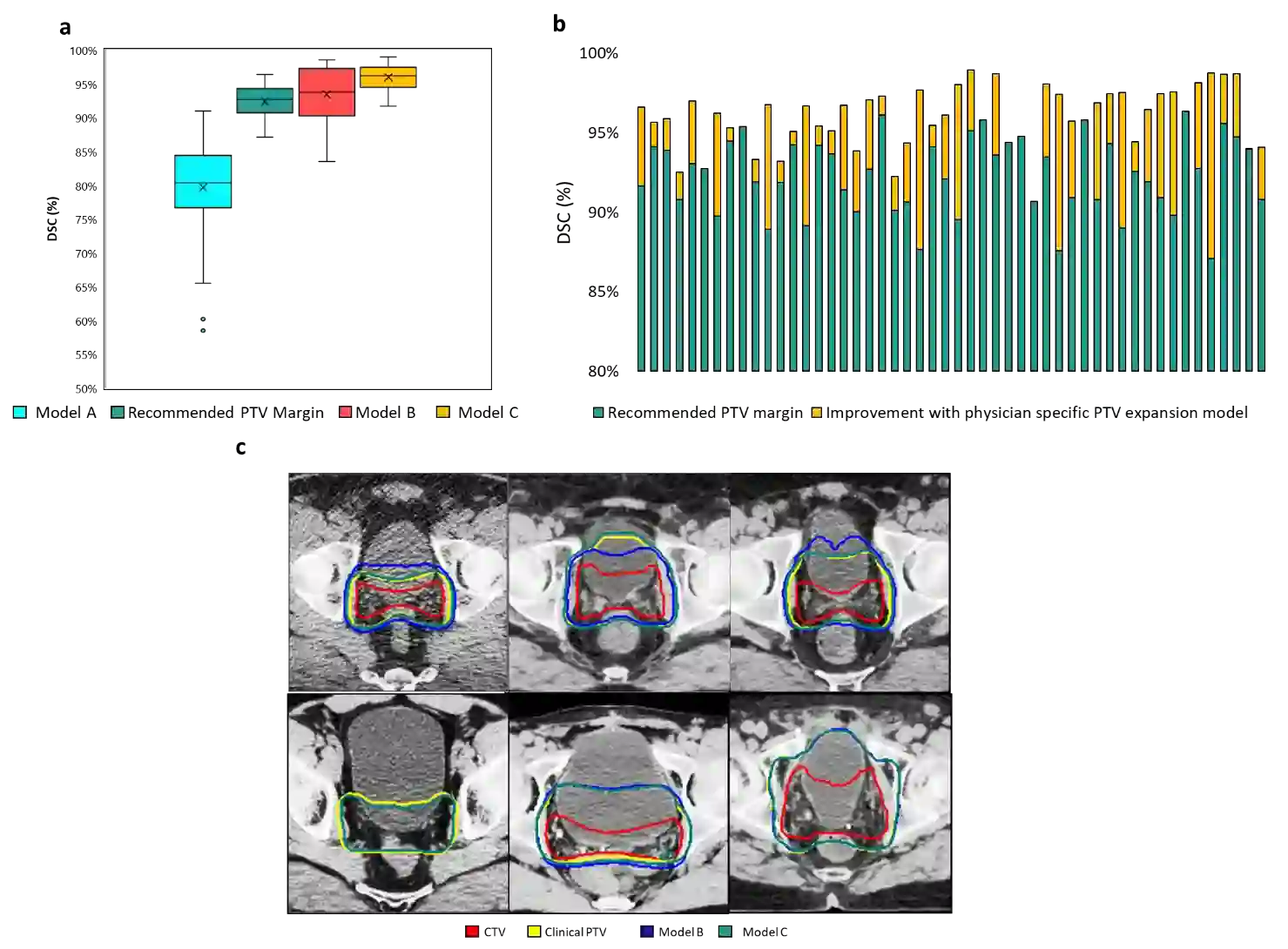
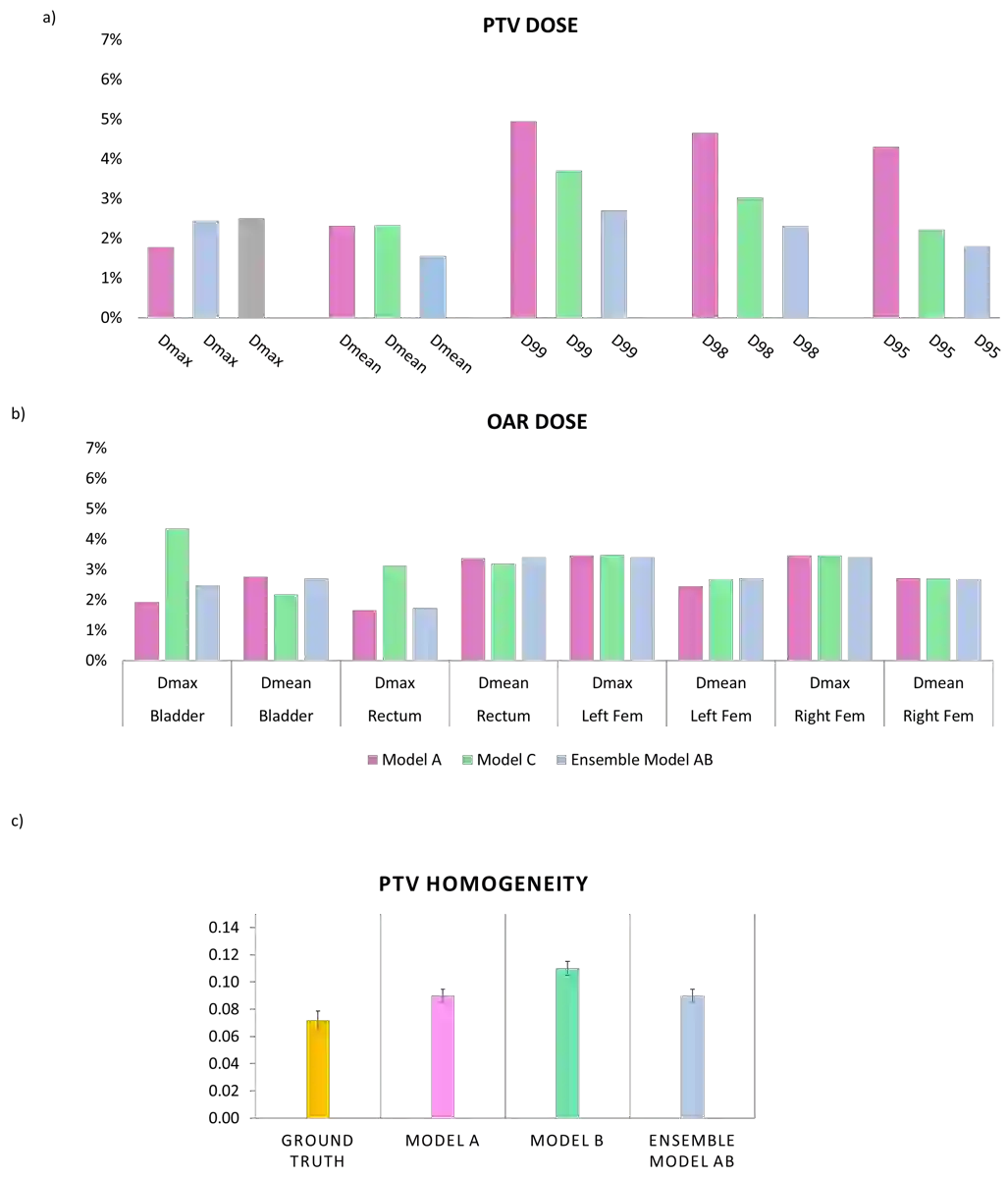
In tumor segmentation, inter-observer variation is acknowledged to be a significant problem. This is even more significant in clinical target volume (CTV) segmentation, specifically, in post-operative settings, where a gross tumor does not exist. In this scenario, CTV is not an anatomically established structure but rather one determined by the physician based on the clinical guideline used, the preferred trade off between tumor control and toxicity, their experience, training background etc... This results in high inter-observer variability between physicians. Inter-observer variability has been considered an issue, however its dosimetric consequence is still unclear, due to the absence of multiple physician CTV contours for each patient and the significant amount of time required for dose planning. In this study, we analyze the impact that these physician stylistic variations have on organs-at-risk (OAR) dose by simulating the clinical workflow using deep learning. For a given patient previously treated by one physician, we use DL-based tools to simulate how other physicians would contour the CTV and how the corresponding dose distributions should look like for this patient. To simulate multiple physician styles, we use a previously developed in-house CTV segmentation model that can produce physician style-aware segmentations. The corresponding dose distribution is predicted using another in-house deep learning tool, which, averaging across all structures, is capable of predicting dose within 3% of the prescription dose on the test data. For every test patient, four different physician-style CTVs are considered and four different dose distributions are analyzed. OAR dose metrics are compared, showing that even though physician style variations results in organs getting different doses, all the important dose metrics except Maximum Dose point are within the clinically acceptable limit.
翻译:在肿瘤分解中,观察者之间的差异被公认为是一个重大问题。这在临床目标量(CTV)分解中甚至更为显著,具体而言,在手术后环境,没有毛肿瘤存在毛肿瘤。在这一假设中,CTV不是一个解剖结构,而是由医生根据临床指南确定的结构,肿瘤控制和毒性、其经验、培训背景等之间的偏好取舍,这导致医生之间的观察者差异很大。观察者变异被认为是一个问题,但其分量后果仍然不清楚,因为每个病人缺乏多位医生的CTV水平轮廓以及剂量规划所需的大量时间。在本研究中,我们分析这些医生的体态变异对高风险器官(OAR)的剂量的影响,通过用深入的学习来模拟临床可接受的工作流程。对于一位医生以前治疗过的病人,我们使用DL-awa工具来模拟CTV是如何配置的,对于这个病人来说,其相应的剂量分配方式仍然不清楚,因为它的分量变化是多位的C值,尽管不同的内部的医生流流流体结构是不同的,我们利用了另外一种直径的C。