这个基因让人更聪明,也让人在舞蹈中死去
|全文共5172字,建议阅读时长6分钟 |
本文经公众号“环球科学ScientificAmerican”(ID: huanqiukexue)授权转载
撰文:基娅拉·祖卡托(Chiara Zuccato)
埃琳娜·卡塔内奥(Elena Cattaneo)
翻译 :马骁骁
当亨廷顿基因发生突变,其中包含的CAG序列超过35组时,人会患上一种被称作“亨廷顿病”的遗传性神经疾病:患者在中年时记忆紊乱,并逐渐失去运动控制能力,直至彻底失去行动能力而死亡。然而,在没有超过35组的情况下,CAG序列越多,却可以让人变得更“聪明”。天才与致命疾病,在这里只是一线之隔。
过去15年以来,英国保险公司一直遵循着一条守则——不使用有投保意向的人的基因信息,来判断他是否可以购买特定人寿保险。但这条禁令有一个例外,就是当涉及到亨廷顿病(以前称慢性遗传舞蹈病)时,保险从业者在部分保险中可以参考购买者的亨廷顿基因信息。
假如购买者的基因检查结果呈阳性,那么保险公司就可以推断,若没有任何治疗,申请者很可能会死于亨廷顿病。该预测的准确率远高于根据他是否吸烟、喝酒或骑摩托车等保险公司常考虑的因素得到的判断。携带这种致病基因的人会在中年(通常为30~50岁)出现情绪变化、记忆紊乱。随后,病情会继续恶化,患者将失去运动控制能力,出现痉挛、行走不稳——这些症状往往被描述为断断续续的“舞蹈”。患者的身体机能将一点点消失,直到彻底失去行动能力而死亡。
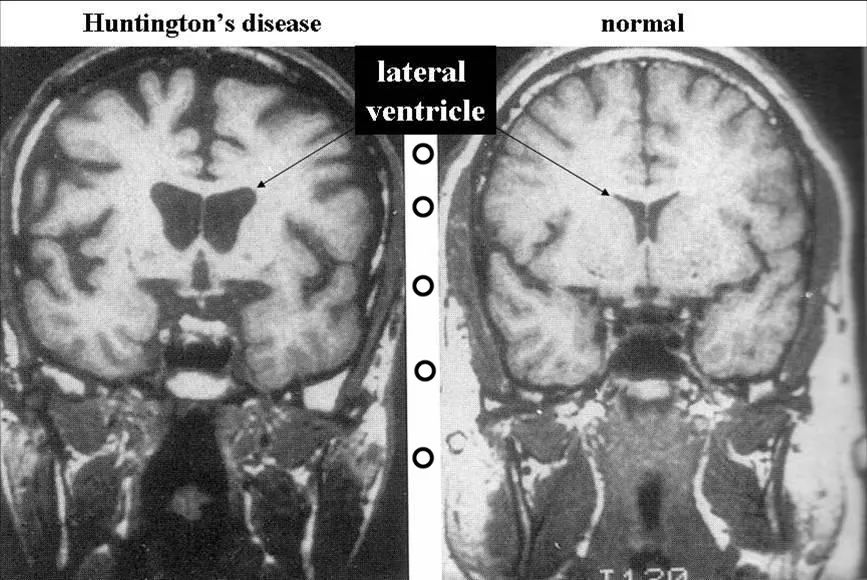
亨廷顿病患者大脑(左)与正常人大脑的对比
研究人员多年前就知道了这种病症的罪魁祸首——一亨廷顿基因(huntingtin)发生了突变。实际上,所有人都携带有亨廷顿基因,因为它对个体出生前的神经系统发育非常重要。但是不同人携带的这种基因略有差别,而正是这种差异,让一些人患上亨廷顿病。
在亨廷顿基因的一段序列中,一个由三个核苷酸组成的短序列——CAG,会重复多次出现。在健康人中,CAG的数量在8到35之间。如果数量超过这个区间,那么最终就将患上亨廷顿病。这种疾病是由乔治·亨廷顿(George Huntington)首次描述的,亨廷顿病因此得名。在每个人从父母那里各自继承的两个基因中,只要有一个有问题就会致病。每个患者的后代均有50%的概率携带该基因。由于这样的遗传特性,在欧美,每10 000个人中就有一个亨廷顿病患者。
研究人员也已知道,亨廷顿病的成因是纹状体和掌管身体运动及高级认知功能的大脑皮层中的神经元死亡。所以很多研究均致力于弄清楚,亨廷顿基因中出现的重复序列为何会导致亨廷顿病,进而研制出阻止病情恶化的药物。
和其他很多国家的实验室一样,我们也在这方面投入了很多精力。但是在过去几年中,我们中很多人渐渐对另一个问题产生了兴趣——为何这种有害的基因可以遗传给一代又一代人呢?为何它没有被自然选择所剔除?我们猜想这是不是一种生物学上的“边缘政策”(brinkmanship)——是不是在一定范围之内,重复序列的数量越多,对生物个体越有利?那些患有亨廷顿病的患者对这个问题的答案也很有兴趣,虽然他们明白这可能对研制药物没有帮助,但仍然想知道问题的答案。
近年来,对这个谜题有很多研究,科学家也对这个基因在人类和其他生物的神经系统发育中扮演的有趣角色有了更深的理解。研究发现,在没有超过致病阈值的情况下,CAG序列的重复次数较多时,神经元的功能会得到提升。从这个角度来看,与其把亨廷顿病定义为一种遗传病,不如把它看做是大脑在演化的道路上走偏了而产生的副作用。CAG序列越多,可以让人变得更“聪明”,但一旦超过了界限便会带来让人痛苦的疾病。这就是“亨廷顿悖论”。
10亿年前出现的古老基因
为了探究这个基因在神经系统的演化中扮演什么角色,研究人员把目光放回到了10亿年前。这时的地球上有一种早期生命,是人类和盘基网柄菌(Dictyostelium discoideum,一种多细胞阿米巴)的共同祖先。它们存活于古元古代和中元古代之间,是最早携带该基因的生物,不过和人类现在的亨廷顿基因略有不同。
盘基网柄菌
2009年,当时任职于德国马克斯·德尔布吕克分子医学中心的米格尔·安德拉德-纳瓦罗(Miguel Andrade-Navarro)和他的研究团队一起搜索了庞大的数据库,找到了阿米巴的亨廷顿基因。安德拉德-纳瓦罗和同事发现,该基因和人类亨廷顿基因的一大差异在于,前者没有CAG序列。尽管如此,这个基因在阿米巴生命周期一个关键阶段(一个个单细胞阿米巴会聚在一块,形成一个叫做伪原生质团的多细胞个体)发挥着非常重要的作用。
当食物紧缺或环境恶劣时,阿米巴聚集体会比单个阿米巴更容易存活。2011年,美国麻省总医院的迈克尔·米雷(Michael Myre)和詹姆斯·古塞拉(James Gusella)研究发现,这个基因能调控很多重要的细胞过程,其中就包括了阿米巴从单细胞向多细胞转变的过程。缺少亨廷顿基因的细胞不容易到处运动,而且很难和其他细胞正常聚合。因此这个基因似乎是细胞互相“交流”的关键因素,对生存很重要。
实际上,这个基因还有很多功能。美国约翰斯·霍普金斯大学的一个研究组发现,这个基因可以控制阿米巴何时分裂,调控阿米巴对环境刺激因素的反应,让它们朝着食物的方向移动。我们实验室发现,盘基网柄菌的亨廷顿基因对哺乳动物的细胞有保护作用,可以防止一些刺激因素触发细胞死亡。
在约5.5亿年前,阿米巴在演化树上分成了两支——原口动物(包括昆虫、甲壳类动物、软体动物)和后口动物。其中,后口动物这一支演化出了脊椎动物,包括鱼类、鸟类、两栖类、爬行动物、哺乳动物、灵长类动物以及现代人类。只有后口动物的亨廷顿基因中渐渐出现了越来越多的CAG序列。
我们在2008年发现,CAG序列最早出现在一类叫棘皮动物的低等后口动物的亨廷顿基因中(如紫球海胆,Strongylocentrotus purpuratus)。我们和米兰大学一个计算方面有着很强实力的研究组合作,测定了海胆基因的DNA序列,在这种动物的亨廷顿基因的开头部分找到了两个CAG序列。
在海胆中,亨廷顿基因的序列和人类的这个基因仍有不少区别。尽管海胆已经有初级神经系统,但亨廷顿基因主要还是在非神经组织中表达。这说明在生物演化的早期,该基因及其携带的两个CAG序列在神经系统中还没有特别重要的功能。对原口动物体内的CAG研究现在还处于初级阶段,但很显然这个短序列出现的频率很低(如蜜蜂基因中只有一个CAG)。大部分情况下,这些原口动物的亨廷顿基因中没有CAG序列。
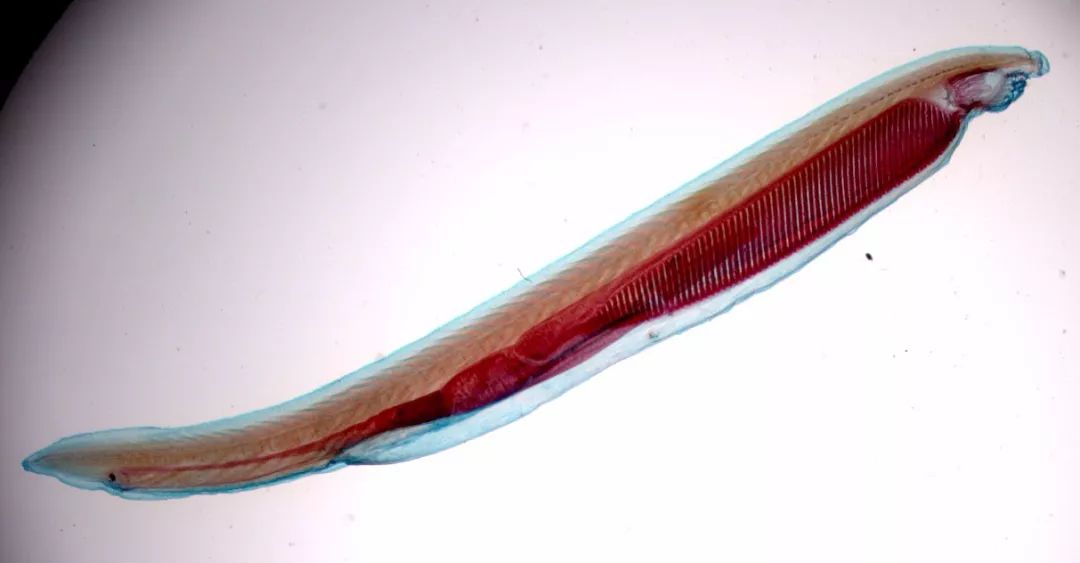
上世纪末,我们实验室分析了其他后口动物的亨廷顿基因序列。最令人惊讶的是文昌鱼(Amphioxus,属于头索动物亚门)的基因序列。对文昌鱼基因的研究,是我们和热那亚大学的马里奥·佩斯塔里诺(Mario Pestarino)合作完成的。文昌鱼是一种小型的类似于鱼类的动物,代表了神经系统在演化过程中的重要节点——从头延伸至尾的神经索结构出现了。文昌鱼的神经索前端又稍微分化,形成一个囊包,似乎是原始大脑的早期前体。
文昌鱼
基因序列显示,和海胆一样,文昌鱼的两个CAG序列也是一起出现的。不同的是,两个CAG周围的基因序列和脊椎动物(包括人在内)的基因很像,而且在文昌鱼中,亨廷顿基因编码的蛋白主要在神经组织中出现。因此我们猜测,这些特点和神经索结构的出现一样,可能是演化出原始大脑的关键因素。
接着,科学家研究了脊椎动物的基因组,发现随着生物体演化出越来越复杂的神经系统,亨廷顿基因中的CAG序列也越来越多。人体内的CAG序列是最多的,在和人类亲缘关系从近到疏的动物中,CAG序列的数量分别是:牛(15个CAG)、猪(18个)、狗(10个)、小鼠(7个)、负鼠(6个),规律显而易见。包括灵长类动物在内的很多动物,不同个体中的CAG数量也并不固定。
脊椎动物是神经系统演化的一个新篇章。脊椎动物在胚胎阶段有一个被称为神经管的空洞结构,这个结构后来会发育成大脑。1997年,麻省总医院的马西·麦克唐纳(Marcy MacDonald)和同事发现,亨廷顿基因和神经管的形成过程有关。2012年,我们组确认并延伸了这一发现:在培养皿中,亨廷顿基因能促进一种类似神经管的结构的发育。
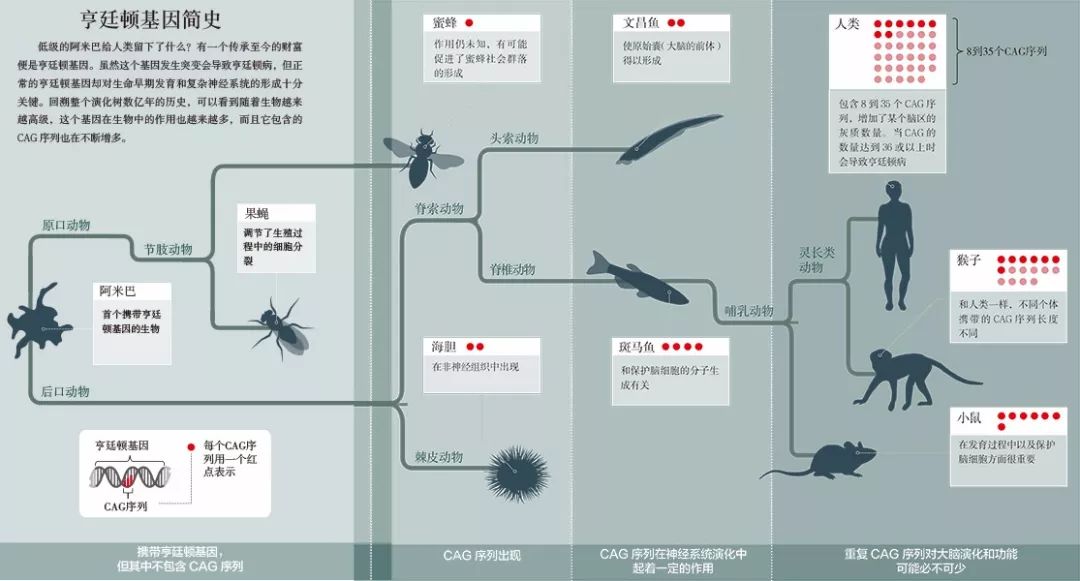
亨廷顿基因简史(点击查看大图)
CAG越多,神经系统越复杂
与此同时,其他方向的研究逐渐揭示出了重复CAG序列的另一个作用——改善大脑功能。这一发现部分源于研究人员寻找亨廷顿基因时的努力。从上世纪70年代,研究人员就开始寻找亨廷顿基因,直到1993年,遗传学家南希·韦克斯勒(Nancy Wexler)及来自亨廷顿病联合研究组的其他57位研究人员才找到人类的亨廷顿基因(位于4号染色体上),并对其进行测序。这个发现为后来确认CAG序列的数量铺平了道路。科学家最终发现,亨廷顿患者携带的CAG为36个或更多。
发现亨廷顿基因一年以后,现任职于英国剑桥大学的遗传学家戴维·C·鲁宾施泰因(David C. Rubinsztein)发表文章指出,健康人体内的亨廷顿基因在遗传给下一代时,CAG序列似乎有增多的趋势。同样在1994年,剑桥大学的诺贝尔奖得主马克斯·佩鲁茨(Max Perutz,曾获1962年诺贝尔生理学或医学奖)发现,谷氨酰胺(CAG编码的氨基酸,是构成蛋白的基本元件之一)会促进蛋白质的合成。但是接下来很长一段时间,后续研究却陷入沉寂。研究人员往往关注CAG序列的非病理性功能。那段时间,科学界将CAG和其他重复性序列看做基因中的“垃圾”,没有什么功能。
2008年,如今任职于美国得克萨斯大学阿灵顿分校的约翰·W·丰东三世(John W. Fondon III)和南伊利诺伊大学卡本代尔分校的戴维·金(David King)猜测,CAG序列可能在神经系统的发育和演化中起作用,而且大脑细胞中CAG序列的增多,可能增强动物的认知能力、性能力以及其他形式的社交能力。戴维·金的推测,重燃了科学家对CAG序列的兴趣。
自那时起,支持这些猜想的证据便不断涌现。加拿大不列颠哥伦比亚大学的迈克尔·海登(Michael Hayden)带领的研究组发现,每17个人中就有1个携带“良性等位基因”——包含27到35个CAG的亨廷顿基因,此时CAG虽多但不会致病。携带较多CAG的健康人群的苍白球(globus pallidus)含有更多灰质——即神经元。苍白球是大脑中掌管计划和控制运动的区域,也参与很多高级认知过程。通过在培养皿中研究脑细胞,我们实验室还发现,CAG越多,动物的神经系统就越复杂。
甚至那些携带致病基因的人也同样展现出了较高的认知能力。2012年,德国鲁尔大学的卡斯滕·萨夫特(Carsten Saft)和克里斯蒂安·贝斯特(Christian Beste)发现,携带致病基因的人在亨廷顿病症状还没出现时,在视觉和其他认知测试中的表现要好于普通人。
待解的亨廷顿悖论
一些关于亨廷顿基因的新研究,还探索了这个基因在大脑中具体起什么作用。我们在培养皿中研究了大脑细胞,结果发现正常的亨廷顿基因会使神经元更“强壮”,能够承受更大压力。相反,其他研究发现,若将小鼠大脑内的亨廷顿基因关闭,则会导致细胞死亡,产生一些和携带有突变亨廷顿基因的小鼠类似的神经疾病症状。我们还发现,该基因还会促进脑源性神经营养因子(brain-derived neurotrophic factor)的生成——一种促进大脑回路形成和神经信号传导的蛋白。
最重要的一点可能是,亨廷顿基因在胚胎发育早期最活跃。简单来说,假如没有这个基因,我们就不会出生。在原肠胚形成(gastrulation)阶段,亨廷顿基因继续工作,主要身体组织就是在这时开始发育的。再后来,亨廷顿基因会调控新神经元的形成,并帮助它们互相连接。
尽管研究取得了诸多进展,科学家依然没有解决亨廷顿悖论。在演化过程中,不断延展CAG重复序列,这可能是亨廷顿基因的“主要成就”,但也正是这种不断延展的趋势,给人类带来了一种灾难性的疾病。围绕着重复序列周围的谜团,未来仍会一直困扰神经科学家。为何这个基因中的CAG序列的数量范围如此之大?当CAG数量接近致病阈值时,大脑中发生了什么变化?为何当CAG数量达到36时,会突然导致亨廷顿病?不过,看到亨廷顿基因的另一面,或许能稍微减轻亨廷顿病所背负的恶名,至少我们不会再简单地将它看做是一种基因缺陷,而是把它视为人类在演化之路上不小心走过头了。
作者简介:
基娅拉·祖卡托是意大利米兰大学生物科学系教授,主要研究亨廷顿病的致病机制。
埃琳娜·卡塔内奥是米兰大学生物科学系的药理学教授,也是意大利议会的终身参议员。
喜欢我们就多一次点赞多一次分享吧~
有缘的人终会相聚,慕客君想了想,要是不分享出来,怕我们会擦肩而过~