“乳”此美好——T-DM1拓展抗HER2治疗适应证,值得更多HER2阳性乳腺癌患者期待
“乳”此美好的生活,不能因乳腺癌而止步。国家癌症中心/中国医学科学院肿瘤医院发布的《2019年中国癌症统计报告》显示,乳腺癌为中国女性发病的首位,乳腺癌的死亡顺位在中国女性中位居肺癌、胃癌、肝癌、结直肠癌以后。
中国人民解放军总医院/解放军医学院2017级肿瘤学专业型硕士研究生
以肺癌、乳腺癌的围手术期和晚期解救性治疗为研究方向
曾参与国家自然科学基金、军队和北京市自然基金项目
已发表论文5篇,其中SCI收录论文1篇,中文4篇
研究结果收录于中国临床肿瘤学会(CSCO)2018年会与美国临床肿瘤学会(ASCO)2019年会
任CSCO会员,中国研究型医院学会肿瘤专业委员会委员
业余科普作家,所撰写的科普文章单篇阅读量超过1万
临床根据乳腺癌病理组织切片中基因表达及蛋白水平将乳腺癌大致分成:Luminal A型,Luminal B型、HER-2+乳腺癌和三阴性乳腺癌(triple negative breast cancer, TNBC)。而乳腺癌中HER-2基因的扩增或过表达乳腺癌约占乳腺癌总数的20%~30%,素来被称为“最凶险”乳腺癌,其是乳腺癌中进展快、易复发转移且预后不良的一类,可谓与三阴性乳腺癌“并驾齐驱”。随着抗HER-2治疗的靶向药物曲妥珠单抗(trastuzumab)、 拉帕替尼(lapatinib)、帕妥珠单抗(pertuzumab)、曲妥珠单抗-美坦新偶联物(ado-trastuzumab emtansine,T-DM1)的问世,其疗效和预后得到了极大的改善。
HER-2基因作用机制
HER-2基因的全称是原癌基因人类表皮生长因子受体2(human epidermal growth factor receptor-2, HER-2),其基因定位于17q21.1,是编码185kDd跨膜受体样蛋白,N(氨基)端为可以与配体结合区域,位于胞内段的C(羧基)端含有络氨酸激酶结构域。HER-2分子的胞外段与配体结合后可以导致分子构象变化,从而发生受体二聚体化,激活胞内段的络氨酸激酶活性,传导细胞增殖信号。其是跨膜络氨酸激酶生长因子受体(HER)家族成员之一,具有酪氨酸激酶活性,在正常细胞的生长发育中具有关键性作用。正常细胞含有大约2万个HER-2的受体,而一些肿瘤细胞却包含有超过200万的HER-2受体,这种现象称为HER-2受体的过度表达。HER-2阳性乳腺癌其绝大部分依赖于HER-2通路来驱动肿瘤细胞的增殖,与肿瘤侵袭性强、复发率高有关。目前病理切片常规会进行HER-2检测,HER-2阳性的定义为:免疫组化(immunohistochemistry)表达为HER-2(3+),或HER-2(2+)进一步行HER-2原位杂交(in situ hybridization, ISH)检测为阳性。
临床应用的抗HER-2药物
临床研究表明,既往标准化疗治疗乳腺癌,HER-2阳性乳腺癌人群预后较差,复发风险高,未经抗HER-2治疗的HER-2阳性MBC患者5年生存率仅为13.2%,与HER-2阴性患者相比,绝对值差异为11.3%,生存率减少46%。对于HER-2扩增阳性的乳腺癌患者,手术、化疗、放疗、内分泌治疗与抗HER-2治疗应并驾齐驱,抗HER-2治疗应坚持尽早、全面和坚持不懈,因为抗HER-2治疗改变了HER-2阳性晚期乳腺癌的治疗结局。在临床工作中,应告知所有HER-2阳性复发/转移乳腺癌患者及时接受HER-2靶向治疗的获益、必要性和重要意义。
曲妥珠单抗是一种重组人源化单克隆抗体,特异性地作用于HER-2的细胞外部位。此抗体含人IgG1 框架,互补决定区源自鼠抗p185 HER-2抗体,能够与HER-2绑定。其于1998年获得美国FDA的批准上市,并于2002年被批准国内上市。曲妥珠单抗显著改变了HER-2阳性乳腺癌的结局,研究证实其能显著提高HER-2阳性早期乳腺癌的治愈机会,显著降低复发和病死风险,显著延长HER-2阳性晚期乳腺癌患者的总生存期(overall survival,OS),显著降低复发和病死风险,是HER-2阳性乳腺癌治疗的标准药物。无论是美国临床肿瘤学会(American Society of clicinal oncology, ASCO)、欧洲肿瘤内科学会(European society for medical oncology, ESMO)、美国国立综合癌症网络指南(National comprehensive cancer network guidelines,NCCN),还是中国临床肿瘤学会(Chinese society of clicinal oncology, CSCO),均将曲妥珠单抗作为抗HER-2靶向治疗药物的首选。
除了曲妥珠单抗,靶向HER-2的药物还有帕妥珠单抗(pertuzumab)、拉帕替尼(lapatinib)、neratinib,我国自主研发的吡咯替尼(pyrotinib)等。
T-DM1初露锋芒
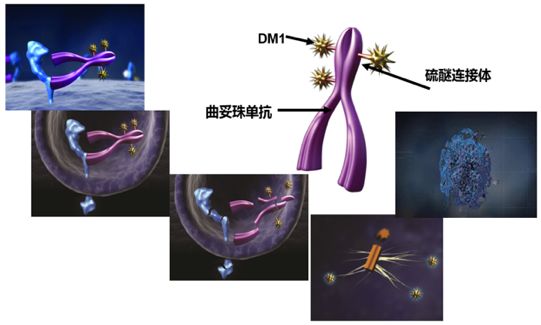
化疗药物常常是“杀敌一千,自损八百”,抗体药物能够精准地寻找肿瘤靶点但往往杀伤力度不够。二者强强联合被称为“生物导弹”的抗体药物强强联合,横空出世。T-DM1(ado-trastuzumab emtansine)是一个靶向HER-2 抗体药物偶合物,其含有人源化抗HER-2 IgG1曲妥珠单抗和微管抑制剂DM1衍生物,两者通过稳定硫醚连接物(MCC)共价连接。T-DM1可结合至HER-2受体的亚结构区Ⅳ,进行受体介导内化和导致溶酶体降解,使得DM1在细胞内释放。而DM1结合至微管蛋白破坏细胞内微管网络,导致细胞周期停止和细胞凋亡。此外,体外研究已证明与曲妥珠单抗相似,T-DM1抑制HER-2受体信号,介导抗体依赖性细胞介导的细胞毒性和抑制过度表达HER-2人乳腺癌细胞生长。
T-DM1结构示意图
KATHERINE研究是对于使用T-DM1替代曲妥珠单抗对复发风险较高的患者进行新辅助治疗,在不增加不可接受的毒性的情况下降低患者复发风险。对1486例HER-2阳性早期乳腺癌患者进行新辅助化疗加HER-2靶向治疗,包括紫杉类药物和曲妥珠单抗,然后进行手术,所有患者在乳房或腋窝淋巴结中都有残留的侵袭性疾病。在手术后随机分配1:1至T-DM1或曲妥珠单抗组,共14个周期。研究的主要终点是无浸润性疾病生存期(iDFS)。结果显示T-DM1组3年iDFS为88.3%,曲妥珠单抗为77%(HR=0.50,95%CI 0.39~0.64,P<0.0001)。亚组分析显示无论患者在新辅助治疗阶段接受曲妥珠单抗还是曲妥珠单抗+帕妥珠单抗,患者的激素受体状态、淋巴结状态、残存病灶的大小,各亚组中T-DM1辅助治疗获益与主要研究终点均一致。基于此,2019年5月3日美国FDA批准T-DM1用于既往新辅助接受抗HER-2靶向治疗后仍存在残存病灶的HER-2阳性乳腺癌的辅助治疗。
MARIANNE研究是T-DM1+/-帕妥珠单抗对比曲妥珠单抗联合紫杉类一线治疗HER-2阳性晚期乳腺癌的随机Ⅲ期临床研究。入组HER-2 阳性乳腺患者均为初治晚期或经紫杉醇类或长春碱类药物(新)辅助治疗后6个月以上出现复发转移者。共1095例入组患者按1:1:1被随机分为三组接受一线治疗:曲妥珠单抗+多西紫杉醇或紫杉醇(HT组);T-DM1+安慰剂(T-DM1组);T-DM1 + 帕妥珠单抗(T-DM1 + P组)。结果显示:含T-DM1一线治疗方案的中位PFS不劣于HT方案。含T-DM1的两组与HT组OS相似,支持T-DM1作为HER-2阳性MBC一线治疗的选择。
EMILIA研究为随机的国际性Ⅲ期研究,纳入991例辅助治疗6个月内或针对转移性疾病治疗后进展的HER-2阳性局部晚期或转移性乳腺癌患者,随机接受拉帕替尼+卡培他滨(n=496)或T-DM1(n=495),T-DM1显著延长了患者的PFS(9.6个月 vs 6.4个月),中位OS为30.9个月对比对照组25.1个月,基于此项研究奠定了T-DM1二线治疗的地位。此外,研究发现PIK3CA突变的患者对T-DM1敏感,而对拉帕替尼不敏感,T-DM1对PIK3CA突变的HER-2阳性转移性乳腺癌(MBC)治疗预后更好。
TH3RESA研究中三分之二的参与者已经接受了4线或以上的治疗,所有患者都接受了至少两种靶向药物。602位患者按2:1的比例被随机分配到T-DM1治疗组或常用化疗组,T-DM1组中位PFS为6.2个月,医生选择组中位PFS为3.3个月,明显优于对照组(P<0.0001)。亚组分析论年龄,地理位置、种族、体力状态、肿瘤特点和脏器疾病,与上述结果一致。Ⅲ期TH3RESA结果显示,T-DM1能够提高既往接受过2种及以上的HER-2靶向治疗的晚期HER-2阳性乳腺癌患者的无进展生存期。根据EMILIA研究,FDA批准T-DM1用于治疗之前接受过曲妥珠单抗和紫杉类化疗的HER-2阳性乳腺癌患者,这无疑为多线治疗以后的患者即使在经受病痛折磨和各种治疗手段之后,仍然有希望的曙光。
此外,PI3K是PI3K/AKT/mTOR 信号通路的上游分子,其异常激活可引起一系列反应。PI3K 通过使AKT 蛋白上的丝氨酸磷酸化位点(Ser473)和苏氨酸磷酸化位点(Thr308)磷酸化而使其激活,对细胞生长和细胞周期具有非常重要的调节作用。Ⅰ期研究评估alpelisib( PI3K 抑制剂BYL719)+T-DM1治疗HER-2阳性转移性乳腺癌的安全性和抗肿瘤活性。该试验中BYL719 与PFS 改善相关,并达到其主要终点。
中国的临床应用
很可惜的是目前T-DM1并未在国内上市,但在《CSCO乳腺癌诊疗指南》 2019版中有所建议和提及:①在HER-2阳性乳腺癌术前治疗章节,推荐术前治疗使用曲妥珠单抗未达到pCR的患者,术后辅助治疗使用T-DM1可以进一步改善预后,提示这类患者的靶向治疗将有新的机遇;②在HER-2阳性晚期乳腺癌治疗的章节,T-DM1作为抗HER-2的二线治疗,位列于Ⅱ级推荐(证据级别1A)。
风雨过后请相信有彩虹。无论是曾经还是现在正在经受乳腺癌折磨的病友,还是在临床一线面对病情棘手的医务工作者,T-DM1的出现无疑是乳腺癌治疗领域的一个重大突破。请始终坚信“乳”此美好的生活会依旧延续,T-DM1也会造福广大HER2阳性乳腺癌患者。
1.Vogel C L, Burris H A, Limentani S, et al. A phase II study of trastuzumab-DM1 (T-DM1), a HER-2 antibody-drug conjugate (ADC), in patients (pts) with HER-2+ metastatic breast cancer (MBC): Final results.[J]. Journal of Clinical Oncology, 2009, 27(5):S375.
2. Verma S, Miles D, Gianni L, et al. Trastuzumab emtansine for HER-2-positive advanced breast cancer.[J]. New England Journal of Medicine, 2013, 368(25):1783-91.
3. Venkatesan P. Trastuzumab emtansine for HER-2-positive breast cancer[J]. Lancet Oncology, 2016, 17:e528.
4. Amiri-Kordestani L, Blumenthal G M, Xu Q C, et al. FDA approval: ado-trastuzumab emtansine for the treatment of patients with HER-2-positive metastatic breast cancer[J]. Clinical Cancer Research, 2014, 20(17):4436-4441.
5. Verma S, Miles D, Gianni L, et al. Trastuzumab emtansine for HER-2-positive advanced breast cancer.[J]. New England Journal of Medicine, 2013, 368(25):1783-91.
6. Krop I E, Kim S B, Gonzálezmartín A, et al. Trastuzumab emtansine versus treatment of physician's choice for pretreated HER-2-positive advanced breast cancer (TH3RESA): a randomised, open-label, phase 3 trial.[J]. Lancet Oncology, 2014, 15(7):689-699.
欢迎乳腺肿瘤专科医生添加肿瘤资讯小助手微信号,加入乳腺肿瘤临床交流群,参与讨论!