华中科技大学同济医学院:局部注射富含miR-21的EVs可以改善心肌梗死预后
缺血性心脏病是全球死亡的主要原因之一。其中,急性心肌梗死(MI)作为一种缺血性心脏病通常会导致很严重的后果。冠状血管的闭塞导致缺氧,导致心肌细胞的显着损失,这通常是不可逆的。目前针对MI的治疗手段包括手术干预和溶栓治疗,但这些治疗手段都可能引起额外的再灌注损伤,包括心肌细胞死亡和微血管损伤等。并且,目前MI的临床治疗基本上是无效的,它们主要旨在缓解临床症状,并不能修复受损的心肌。由于剩余心肌细胞的再生能力不足,经受严重MI的患者的心肌损伤通常会严重影响心功能,降低患者生活质量,甚至威胁患者声明。因此必须开发治疗MI的有效替代方案,同时减少心肌细胞损失,以改善MI的预后。
近年来,microRNAs(miRNAs)已被用于治疗心血管疾病(CVDs)。 miRNA是一类小的非编码RNA,通过与靶mRNA的3'非翻译区(UTR)碱基配对来调节基因表达,这反过来导致mRNA降解或翻译抑制。越来越多的研究表明,miRNA参与MI后心脏血管生成,细胞凋亡和纤维化的调节,这些研究成果使其成为MI治疗的潜在药理学候选者。然而,体内稳定性不足和细胞摄取不良等因素限制了miRNA的临床应用。 尽管已经开发了几种方法,例如流体动力注射,病毒载体,脂质体和纳米载体来递送miRNA,但这些方法与载体毒性,递送效率低和不良免疫反应相关。 因此,非常需要可靠和有效的递送方法。
细胞外囊泡(EVs)是一组细胞分泌的异质性封闭膜泡结构,直径范围在30-1000 nm,具有与脂质体相似的脂质膜结构。EVs膜的稳定性不仅可以有效保护感兴趣的核酸货物免于降解,还可以快速将miRNA,mRNA和蛋白质转运到受体细胞中,而不会引起毒性和不良免疫反应。目前的技术手段可以修改EV中的miRNA以满足通过预处理或基因工程治疗不同疾病的需要。因此,EV可能是体内miRNA递送的最佳选择。迄今为止,EV越来越多地被作为生物标志物在心血管疾病被研究,同时来自各种干细胞,包括间充质干细胞(MSCs),心脏祖细胞(CPC),胚胎干细胞(胚胎干细胞和诱导多能干细胞(iPSCs)),的细胞外囊泡都被用来尝试进行了心脏修复。然而,干细胞的传代数量是有限的,并且EV的产量通常非常低,限制了EV用于研究和临床治疗的广泛使用。据报道,在miRNAs中,miRNA-21(miR21)通过靶向梗塞心肌细胞中的PDCD4 / AP-1来抑制细胞凋亡,并通过激活PTEN / Akt信号传导和刺激血管内皮生长因子(VEGF)的表达促进内皮细胞的血管生成。
基于以上的研究进展,利用miRNA-21的抗细胞凋亡和血管生成促进功能,来自华中科技大学同济医学院的研究人员尝试设计了源自血清饥饿和转基因HEK293T细胞的富含miRNA-21的EV。首先,研究者们通过携带miR-21过表达系统的病毒侵染HEK293T细胞,利用药物筛选得到稳定过表达miR-21的HEK293T细胞并用于条件培养液的制备。然后,将细胞外囊泡通过超速离心的方法从条件培养液中分离纯化出来。最后,通过受损心肌局部注射进行细胞外囊泡的施用。通过一系列的生理病理学评估表明,来自HEK293T细胞,携带大量miR-21的细胞外囊泡能够降低心肌梗死之后的心肌损伤,并且能够挽救心脏的功能。这一研究报道具有十分重要的临床指导意义。为心肌梗死治疗过程中真正的缓解心肌细胞凋亡的治疗策略提供了极具价值的参考数据。
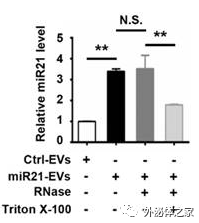
miR-21在HEK293T的过表达能够提升EV中miR-21的水平
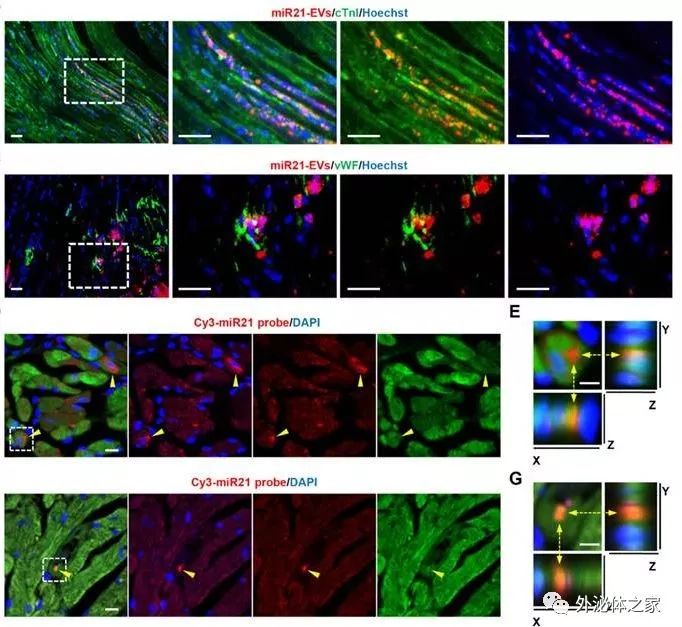
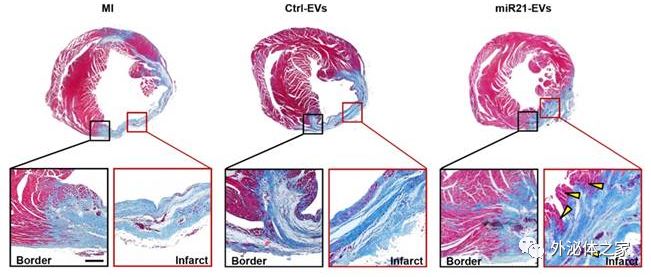
EV携带miR-21能够降低紧急梗死中心肌细胞损伤
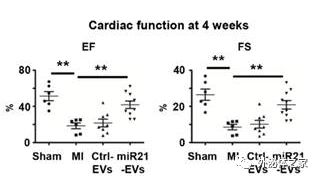
EV-携带的miR-21能够改善心肌梗死后心脏功能的恢复
本文通讯作者为华中科技大学同济医学院的王琳、王征、董念国、王国斌老师。
参考文献:Localized injection of miRNA-21-enriched extracellular vesicles effectively restores cardiac function after myocardial infarction.
【科研成长加油站】
2019年中国肿瘤标志物学术大会暨第十三届肿瘤标志物青年科学家论坛
系统评价与meta分析学习班和临床科研设计和数据管理学习班( Meta班:6/27-30;上海临床管理班:7/2-4)
肿瘤免疫课题设计、前沿技术、文章写作、基金申请培训班 解析肿瘤免疫,一手全掌握(上海 6/29-30)
回复“外泌体” 阅读外泌体最新科研进展及动态
回复“EV” 阅读 2016-2018年This Week in Extracellular Vesicles
回复“盘点” 阅读 外泌体领域十大前沿进展盘点