病例1
【Blood】如何治疗乳腺假体相关间变大细胞淋巴瘤
间变大细胞淋巴瘤(ALCL)是少见T细胞非霍奇金淋巴瘤,普遍表达CD30,亚型包括ALK阳性、ALK阴性及较为惰性的原发皮肤ALCL,三者组织学相似,但临床经过完全不同。最近认识到的乳腺假体相关间变大细胞淋巴瘤(BIA-ALCL),2016年WHO分类中为临时分类,其治疗决定多来自回顾性研究、专家意见和临床经验。美国Neha教授在BLOOD杂志发文,就BIA-ALCL的诊疗给出了相关推荐。
流行病学
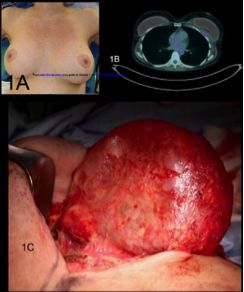
1997年报道了首例BIA-ALCL,41岁女性,肿瘤生长于毛面乳腺假体的纤维包膜内,与ALCL相似,表达CD30。乳腺假体按照外层质地分为光面和毛面型,多认为毛面型可减少假体异位和挛缩,但并无大型前瞻性研究证实。目前所有BIA-ALCL均来自毛面假体。自1997年,23个国家报道了500余例BIA-ALCL,多数病例因血肿导致乳腺肿胀和不对称而诊断(图1)。BIA-ALCL通常发生于术后7-10年,发生率约为33/100万毛面假体。
图1 BIA-ALCL实例
患者女,43岁,10年前行双侧毛面硅胶假体植入,左乳进行性肿胀3周,伴压痛,无充血和发热,否认乳腺外伤。体检见乳腺明显不对称,无充血、波动、固定和瘀斑。
病例2
患者女,68岁,左乳肿物4周就诊,7年前患侵袭性乳腺导管癌,T3N2MX,ER/PR阳性,Her2阴性,行左乳切除、术后辅助化疗和乳房重建,3个月前停用芳香化酶抑制剂。超声见毛面假体周围有300ml血肿,MRI见血肿包绕假体,假体包膜上有一1cm肿物。
临床表现
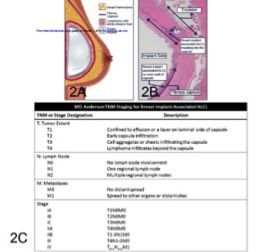
BIA-ALCL中位诊断年龄55岁,60%-80%病例表现为持续血肿伴乳腺肿胀、不对称和疼痛。假体植入后≥1年的迟发血肿见于0.05-0.1%的毛面假体患者,发生BIA-ALCL风险约为10%。毛面假体血肿原因除BIA-ALCL外,还包括外伤和感染。BIA-ALCL导致的血肿通常包绕假体,较少累及或侵犯纤维包膜(图2),15%有腋下淋巴结肿大,10-20%表现为乳腺肿物,其它少见表现包括皮损、包膜挛缩、包膜受累和B症状。
图2 BIA-ALCL模式图和TNM分期系统
BIA-ALCL的风险因素主要是毛面假体,此类假体在澳大利亚、亚洲、欧洲和南美广泛应用,美国不足13%。多认为BIA-ALCL的发病机制是毛面假体诱发明显的局部T细胞免疫反应(辅助性和细胞毒性)所致。研究显示,毛面假体表面积增加导致炎症风险增加,启动CD30+T细胞克隆扩增,毛面假体切割硅胶成为颗粒,被巨噬细胞摄入后成为泡沫细胞,分泌炎症因子,如IL-1、IL-6和TNF,加重T细胞化学趋动和复制;另有研究认为(图3D)BIA-ALCL源于IgE和IL-10介导的过敏性炎症瀑布;也有认为革兰氏阴性菌脂多糖膜可能诱导淋巴细胞过度增生。然而上述理论均未能进一步证实。
BIA-ALCL可发生JAK-STAT途径体突变,其它突变包括SOCS1、TP53和DNMT3A突变,JAK和STAT3双突变,与ALK阴性ALCL相似。部分BIA-ALCL有JAK3途径胚系突变,因此有假说认为宿主因素可能有助于BIA-ALCL发生。
可疑病例的评估
除钼靶外,无症状者不推荐更多检查与预防性手术,有症状的可疑BIA-ALCL,尤其是假体植入1年后发生血肿者应行超声或MRI评估,如发现假体周围渗液与肿物应排液或肿物活检,渗液行细胞学和流式细胞学检查对评估BIA-ALCL非常重要,检查时要尽量多留取渗液。乳腺肿物或淋巴结肿大者,活检联合流式细胞学检查非常重要,病理医师对可疑BIA-ALCL应行特异性标志检查以便诊断,如CD30。T细胞基因重排也有助于诊断,但部分系统性ALCL并无T细胞受体克隆性改变,相反一些反应性T细胞却可以假阳性。乳腺肿物如果有包膜外浸润则是不典型BIA-ALCL,如病理依旧不能明确诊断,应密切随访,重复活检或渗液检查并考虑血液病理会诊。诊断不确定者尚无标准实践方案,但至少3-4个月重复评估比较合理。如病理结果阴性,可就诊整形外科治疗良性血肿。对可疑淋巴结肿大,PET/CT有助于确定最适合活检的部位。
病理定义
多数BIA-ALCL表现为假体周围渗液,因此FNA标本细胞学检查很有必要,至少需要10 ml渗液,50ml更理想,并提示病理医师注意BIA-ALCL可能。标本检查包括涂片,或离心涂片石蜡包埋后分析形态学和免疫表型。二种方法均较易确定BIA-ALCL,恶性细胞通常较大、多形性、胞膜不规则、胞浆丰富有空泡、核较大且多形性多分叶,核仁突出(图3A和B)。需注意细胞学改变常与其它恶性细胞重叠,尤其是高级别乳腺癌,所以充分的免疫表型(免疫组化为优,图3C)和流式细胞学检查(图3E,3F,3G)对诊断很重要。
图3 A)渗液离心后的IA-ALCL细胞;B)包膜切除标本中BIA-ALCL的组织学形态;C) BIA-ALCL 表达CD30 ;D) 毛面假体包膜内吞噬硅胶颗粒的巨细胞反应; E 、F和G) BIA-ALCL渗液的流式细胞学分析免疫表型,紫色为肿瘤细胞,表达CD4和CD2(E),CD3阴性(F),强表达CD30(G为CD30设门)。
手术切除假体、全包膜切除及切缘阴性的所有肿物切除是BIA-ALCL的主要治疗,需仔细检查标本,明确侵犯深度和切缘状态。组织学切片中,多数肿瘤细胞位于邻近假体的纤维性渗液中(图2),有时也可见到肿瘤细胞侵入纤维包膜里或播散至腋下淋巴结。肿瘤细胞常成簇状,细胞学特征与全身ALCL相似(图3)。
免疫表型对诊断很有帮助,胞膜强表达CD30、高尔基体模式、经常表达CD4,缺少其它T细胞标志如CD3和CD5,ALK阴性。正常淋巴细胞、癌细胞和髓系细胞也表达CD30,所以需全面T细胞表型检查以明确肿瘤细胞表型。如BIA-ALCL超过假体包膜进入邻近组织或区域淋巴结,单纯形态学、免疫表型或遗传学特征不能与ALK阴性系统性ALCL区分。外科医师、影像学医师和病理医师相互沟通对BIA-ALCL诊断和分期非常重要,BIA-ALCL的DUSP22和TP63阴性,但不常规用于诊断。
病例1继续
进一步行双侧乳腺超声检查,右乳无显著变化,左乳见大量渗液包绕假体,无腋窝淋巴结肿大。血肿细针活检主要见淋巴细胞,流式细胞学分析表达CD4、CD2、CD30,CD3和CD8阴性,无乳腺癌证据。PET/CT亦未见淋巴结肿大及左乳外的淋巴瘤证据。
病例2继续
淋巴结粗针活检见大的非典型淋巴细胞,高度考虑淋巴瘤,无乳腺癌证据。血肿流式细胞分析见大的T细胞,表达CD4和CD30,CD5和CD8阴性。PET/CT见左乳假体包膜有一高代谢2cm肿物,左腋下有2.5cm和3cm的2个高代谢淋巴结。其它区域无淋巴瘤证据。
高度可疑或证实的BIA-ALCL
组织学证实BIA-ALCL或高度可疑BIA-ALCL,如有可能应行PET/CT评估是否有包膜肿物、胸壁侵犯和乳腺区域外疾病。Neha教授更倾向于术前PET/CT检查,因为术后炎症或伤口愈合可能会影响对胸壁和腋下淋巴结评估,此外术前发现可疑淋巴结可在术中取样。弥漫性疾病需要组织学证实,骨髓活检适合高度可疑骨髓受累或无原因全血细胞减少者。FDA推荐所有诊断病例均应向ASPS PROFILE登记处报告,便于前瞻性观察BIA-ALCL疾病特征和肿瘤结果,并与MD Anderson合作实施病理组织银行中心化。截至2018年6月,登记处已有226例美国BIA-ALCL病例,全世界561份病例。
分期与预后
采用Lugano Ann Arbor修订分期,几乎所有BIA-ALCL均为早期,1E(83%-84%)、IIE(10%-16%),NCCN推荐BIA-ALCL TNM分期系统,大部分患者为局限性疾病,单纯手术即可治愈(图2C)。I期淋巴瘤存在于渗液中或穿入假体包膜但未超越包膜。IIA疾病局限于乳腺,但侵犯入包膜周边组织,IIB累及单一区域淋巴结。超过同侧乳腺和区域淋巴结的疾病均为IV期,转移至肝脏、小肠或骨的疾病也有报道。目前共有16例疾病相关死亡,多是疾病侵入胸壁和纵隔。
一项早期BIA-ALCL研究显示,I期患者3年OS100%,3年EFS63%,事件包括淋巴瘤复发、持续存在、进展或死亡。另一87例患者的队列研究中,I期患者3年OS和EFS分别为93%和63%。上述数据证实局限性疾病虽有局部复发风险,但总生存很好。II期疾病3年EFS63%,III期3年EFS29%,III期局部复发风险更高。Clemens研究证实,完全手术切除的局限期BIA-ALCL结果改善,手术是治疗关键。
治疗
手术治疗
及时诊断并完全切除肿物和假体包膜是BI-ALCL的优选治疗,根治性乳腺切除的作用不清,因BI-ALCL并不是乳腺本身疾病。单纯手术对超过80%的局限于包膜疾病和可切除胸壁肿物已足够(Lugano IE,MDA IA-IIA)。可疑增大淋巴结在术中需活检,前哨淋巴结活检并不适合,全腋下淋巴结切除对减少疾病复发亦无更多获益,术前PET-CT对鉴别可疑淋巴结有益。大约4.6%的患者有双侧假体包膜受累,推荐对侧毛面假体也进行手术。手术完整切除包膜非常重要,因为残留的疤痕包膜与疾病复发和进展相关。由于局部复发率增加,不完全切除术后需要辅助治疗,如局部放疗或全身治疗。术前PET/CT可指导手术切除以确保所有包膜相关肿物完全切除。
包膜切除时渗液外漏的后果尚不清楚,但外漏几乎不可避免,目前未见影响复发率。术中冰冻切片可指导更精准切除,如边缘阳性时可切除更多组织,但因CD30免疫组化并不能立刻进行而妨碍病理检查。如术后病理显示边缘阳性,Neha教授团队会再次手术,此时应考虑美学结果,如使用已有的乳腺疤痕、乳腺下褶皱切除或手术联合乳腺固定以便重塑乳腺外形和皮肤。对局限性疾病已完全切除者,肿瘤学结果很好,大部分患者长期无病生存,疾病残留、阳性边缘或不可切除疾病伴胸壁侵犯者可能获益于辅助治疗。
重建手术的时机尚无标准指南,不推荐毛面假体重建。Neha教授采取立即重建和6个月-2年的延迟重建二种方法,主要有自体组织重建、脂肪植入和光面假体重建。Neha教授的一位患者在2年随访时发现光面假体重建后的疾病复发并再次成功切除,目前不清楚复发与第一次手术时不完全切除还是再次假体植入有关。总之,重建时机和类型需根据疾病程度、再次切除可能性及患者意愿确定。
辅助治疗
局部较高复发风险患者缺少标准治疗,如肿物和淋巴结转移不完全切除者,应予辅助放疗和/辅助化疗,但有报道显示局部复发后再行放疗和化疗也可成功治疗,因此辅助化疗或放疗对高危复发患者的作用仍不清楚。疾病超过包膜较局限于包膜时复发风险更高,所以残留疾病或切除不完全者,Neha教授认为术后应局部放疗(24-36Gy)比较合理,乳腺癌放疗史患者应考虑辅助化疗或brentuximab vedotin治疗,此种情况并不常见,亦无证据临床获益。乳腺外疾病复发应考虑全身治疗。
病例1继续
该患者接受双侧包膜和假体完全手术切除,包膜评估未见侵犯和肿物,假体周围渗体中见大的非典型淋巴细胞,表达CD4、CD2和CD30,CD3或CD8阴性。术后患者持续随访,4年时无复发证据。
病例2继续
患者接受双侧假体和包膜切除,切缘阴性,有一1 cm肿物侵犯,并未穿透包膜,内含不典型淋巴细胞,表达CD3、CD4 和CD30,CD5、CD7 和CD8阴性,符合BIA-ALCL。淋巴结活检见大的不典型淋巴细胞,表达CD3、CD4 和CD30,CD5、CD7和CD8阴性。心脏彩超射血分数65%,予3周期CHOEP和3周期CEOP,治疗结束后PET/CT显示完全代谢缓解。
How I treat breast implant-associated anaplastic large cell lymphoma.Blood 2018 :blood-2018-03-785972
http://www.bloodjournal.org/content/early/2018/09/11/blood-2018-03-785972
41本肿瘤患者指南丛书
点击下方图片即可免费阅读
70个肿瘤相关临床试验招募患者
点击下方图片或识别图片二维码即可查看详情