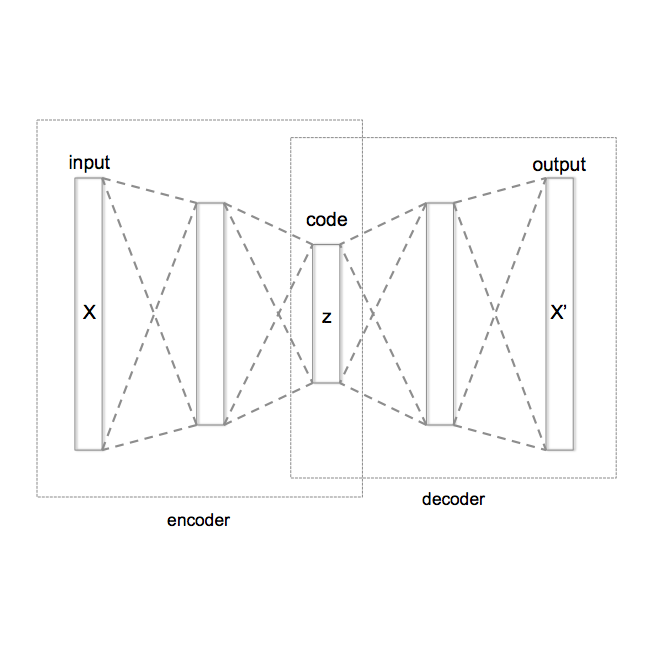
Cardiovascular diseases (CVD) are the leading cause of death globally. Non-invasive, cost-effective imaging techniques play a crucial role in early detection and prevention of CVD. Optical coherence tomography (OCT) has gained recognition as a potential tool for early CVD risk prediction, though its use remains underexplored. In this study, we investigated the potential of OCT as an additional imaging technique to predict future CVD events. We analysed retinal OCT data from the UK Biobank. The dataset included 612 patients who suffered a myocardial infarction (MI) or stroke within five years of imaging and 2,234 controls without CVD (total: 2,846 participants). A self-supervised deep learning approach based on Variational Autoencoders (VAE) was used to extract low-dimensional latent representations from high-dimensional 3D OCT images, capturing distinct features of retinal layers. These latent features, along with clinical data, were used to train a Random Forest (RF) classifier to differentiate between patients at risk of future CVD events (MI or stroke) and healthy controls. Our model achieved an AUC of 0.75, sensitivity of 0.70, specificity of 0.70, and accuracy of 0.70, outperforming the QRISK3 score (the third version of the QRISK cardiovascular disease risk prediction algorithm; AUC = 0.60, sensitivity = 0.60, specificity = 0.55, accuracy = 0.55). The choroidal layer in OCT images was identified as a key predictor of future CVD events, revealed through a novel model explainability approach. This study demonstrates that retinal OCT imaging is a cost-effective, non-invasive alternative for predicting CVD risk, offering potential for widespread application in optometry practices and hospitals.
翻译:暂无翻译