全面评估单碱基编辑技术mRNA脱靶风险
Pixabay.com
撰文 | 黄宇翔
责编 | 陈晓雪
● ● ●
许多严重的疾病来自基因突变,因此基因编辑技术的进步为脊髓性肌营养不良、地中海贫血、视网膜黄斑变性等遗传性疾病患者带来了希望。[1]
但是,在将体细胞基因编辑技术向临床推进、造福患者的道路上,研究者对技术潜在的安全性问题必须小心谨慎,在临床试验以前对风险做充分的评估。脱靶效应始终是悬挂在利用基因编辑技术进行疾病治疗头上的 “达摩克利斯之剑”。
基因编辑技术的脱靶效应又可以细分为基因组和转录组两个层面,此前的大量研究都关注于基因编辑技术在基因组层面对于DNA的脱靶效应分析。[1-3]
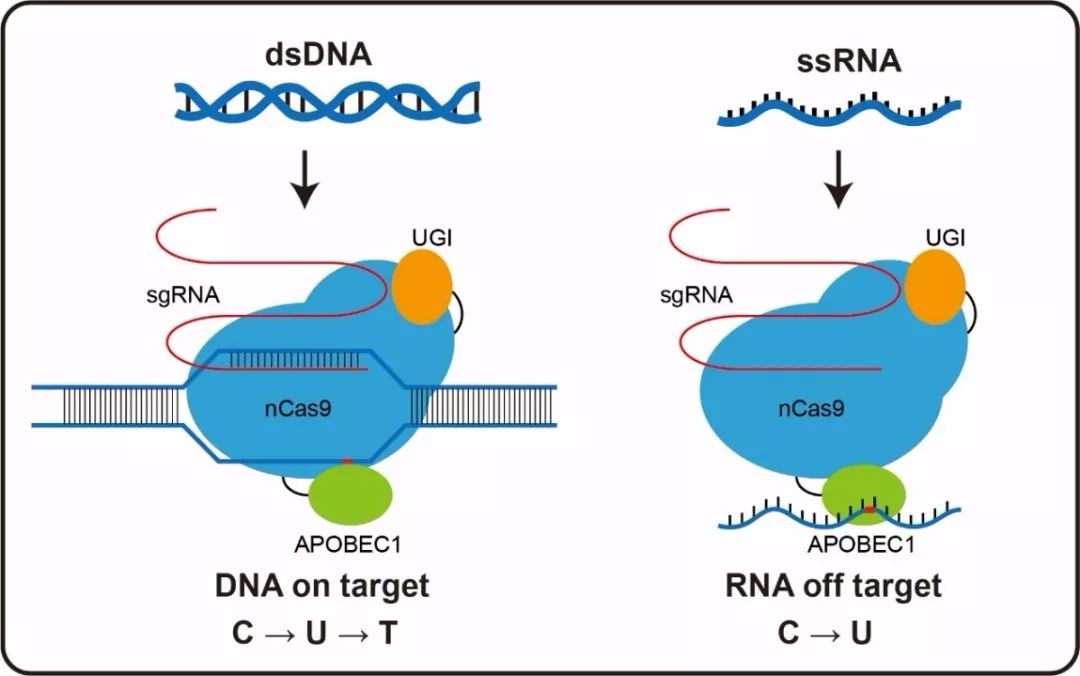
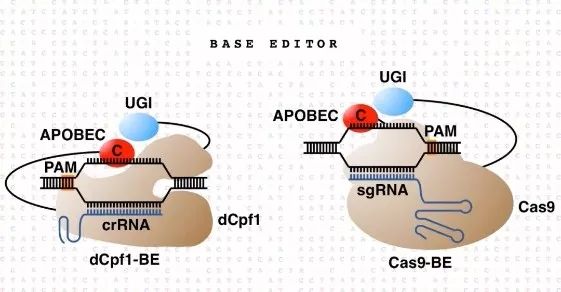
2019年6月10日,《自然》杂志上线的一篇论文显示,中国科学家对于单碱基编辑技术(在CRISPR/Cas9 基础上开发的一类基因编辑技术)在 mRNA 水平上的脱靶效应进行了全面细致的分析。研究者发现,即使目前领域内最先进的单碱基编辑工具 BE3 和ABE7. 10,也都存在不容忽视的 mRNA 脱靶效应。他们通过引入点突变的方法,对现有的单碱基编辑工具进行了改良,获得了 mRNA 脱靶率较低的单碱基编辑工具。这一具有更高精度的工具,将为未来单碱基编辑工具应用于临床治疗打下坚实的基础。[4]
本研究由中国科学院神经科学研究所、脑科学与智能技术卓越创新中心杨团队,四川大学华西二院、生命科学学院郭帆团队和中国科学院-马普学会计算生物学伙伴研究所研究员李亦学团队共同完成。
研究者以 HEK293T 细胞系为模型开展本项研究。通过对混合细胞和单细胞转录本进行测序分析,研究者发现表达单碱基编辑工具BE3和ABE7. 10都会显著提升 mRNA 中突变的数目。对所引发的突变序列进行分析,研究者发现这些突变在一些原癌基因和抑癌基因中富集程度比较高,这意味着未来的研究者在试图将单碱基编辑技术应用于临床时,需要对该技术诱发癌症的风险进行评估。[4]
为了降低现有工具的 mRNA 脱靶率,研究者通过突变优化和尝试人源结构域的方法,获得了具有高DNA编辑效率、低RNA脱靶率的BE3W90A、BE3 (hA3AR128A)、BE3 (hA3AY130F)、ABE7. 10F148A等优化版单碱基编辑工具。这些新工具能将检测到的RNA突变率降低到与阴性对照相近的水平,其表现超过了此领域领军科学家David Liu团队和Keith Joung团队为降低mRNA脱靶率而独立开发的优化版本。[4-6]
本图由杨辉实验室提供。
不同于构成基因组的 DNA,mRNA 在细胞中存在很多个拷贝,那为什么少数一些mRNA的异常会引起研究者如此高度的重视?“RNA的脱靶效应会影响正常细胞的功能。” 该项研究的通讯作者之一杨辉告诉《知识分子》。“如果长期造成RNA的脱靶效应,比如在AAV(腺相关病毒)介导的成体基因治疗中”,细胞内RNA的突变会影响细胞的正常生长,甚至可能会有致癌风险。[7-9]

[1] Reeset al., (2018) Base editing: precision chemistry on the genome and transcriptome of living cells. Nature Reviews Genetics. DOI: 10.1038/s41576-018-0059-1
[2]Zuo, E. et al., (2019) Cytosine base editor generates substantial off-target single-nucleotide variants in mouse embryos. Science, DOI:10.1126/science.aav9973
[3]Jin,S. et al., (2019) Cytosine, but not adenine, base editors induce genome-wide off-target mutations in rice. Science, DOI:10.1126/science.aaw7166
[4] Zhou et al., (2019) Off-target RNA mutation induced by DNA base editing and its elimination by mutagenesis. Nature.
[5] Grünewaldet al., (2019) Transcriptome-wide off-target RNA editing induced byCRISPR-guided DNA base editors. Nature. DOI: 10.1038/s41586-019-1161-z
[6] Reeset al., (2019) Analysis and minimization of cellular RNA editing by DNA adenine base editors. Science Advance. DOI: 10.1126/sciadv.aax5717
[7]Villiger, L. et al., (2018) Treatment of a metabolic liver disease by in vivo genome base editing in adult mice. Nat Med. DOI:10.1038/s41591-018-0209-1
[8]Rossidis, A. C. et al., (2018) In utero CRISPR-mediated therapeutic editing of metabolic genes. Nat Med. DOI:10.1038/s41591-018-0184-6
[9]Maeder, M. L. et al., (2019) Development of a gene-editing approach to restore vision loss in Leber congenital amaurosis type 10. Nat Med. DOI:10.1038/s41591-018-0327-9
制版编辑 | 皮皮鱼
更多精彩文章:
点击“阅读原文”,与知识分子一起悦读2019。