肿瘤治疗之:靶向氨基酸代谢
点击上方“转化医学网”订阅我们!
干货 | 靠谱 | 实用
肿瘤细胞氨基酸代谢途径的改变往往由多种信号通路和转录因子共同驱动。大量基础及临床试验研究表明,靶向肿瘤依赖性氨基酸的代谢,发展新型药物,可有效抑制肿瘤的生长。本文就为大家介绍靶向氨基酸代谢治疗肿瘤的几种途径。
靶向精氨酸代谢途径
精氨酸由瓜氨酸通过精氨琥珀酸合成酶1(ASS1)和精氨琥珀酸裂解酶(ASL)的两步催化合成,然后精氨酸酶1(Arg1)将精氨酸分解成鸟氨酸和尿素。
通过Arg和鸟氨酸转氨甲酰酶(OTC)将鸟氨酸转化为瓜氨酸以在线粒体中再循环。其中ASS1、ASL或OTC的异常会影响细胞内精氨酸的储存。在肿瘤中常见ASS1缺乏,导致肿瘤细胞获取血清中的精氨酸。因此,血清中精氨酸的快速消耗可作为癌症治疗的新策略。精氨酸脱亚胺酶(ADI)和Arg1等可以分别通过将精氨酸转化为瓜氨酸和鸟氨酸来耗尽血清中的精氨酸,产生抗肿瘤活性。ADI和Arg1介导的抗肿瘤机制包括:诱导细胞周期停滞、细胞凋亡、自噬和抑制血管生成。
来源于支原体的ADI与聚乙二醇缀合得到ADI-PEG20,抗原性显著降低且半衰期明显提高。ADI-PEG20的抗肿瘤活性已在胰腺癌、前列腺癌、小细胞肺癌、淋巴瘤、头颈癌、粘液纤维肉瘤、恶性黑色素瘤、胶质母细胞瘤和乳腺癌中得到证实。ADI-PEG20和重组的聚乙二醇化的人精氨酸酶(rhArg1-PEG)通过消耗血清中的精氨酸,使肿瘤细胞生长受到抑制,呈现抗肿瘤活性,抗肿瘤应用与作用机制被广泛研究。
ADI在人体内的免疫原性会影响药物效果,但ADI与其他抗肿瘤药物组合可以改善治疗功效。例如,ADI与地塞米松(DEX)的联合用药对T淋巴细胞白血病细胞以及抗DEX的白血病细胞有协同作用。在前列腺癌细胞中,多西紫杉醇和ADI-PEG20显示出协同作用。另外,ADI-PEG20可增强培美曲塞在膀胱癌中的活性。ADI-PEG20和多柔比星在乳腺癌中的协同作用也被证实。除常规化疗和放疗外,ADI与细胞凋亡诱导剂TRAIL的联合用药也可协同促进恶性黑色素瘤细胞死亡。因此,靶向精氨酸代谢药物与其他癌症治疗方式联合在肿瘤的有效治疗上是有前景的。
靶向谷氨酰胺代谢
正常细胞可通过自身合成产生谷氨酰胺,但肿瘤细胞依靠自身合成的谷氨酰胺不能满足其快速增殖的需要,需要通过膜上转运体从胞外摄入谷氨酰胺或增强谷氨酰胺代谢通路中关键代谢酶的表达与活性,以维持细胞增殖的需要。
肿瘤细胞依靠细胞膜上的SLC(solute carrier)超家族转运蛋白从细胞外环境中摄取谷氨酰胺。转运谷氨酰胺进入细胞的关键转运体SLC1A5、SLC7A5、SLC7A11以及SLC6A14在肿瘤细胞中发挥重要作用。其中转运蛋白SLC6A4在结肠癌、宫颈癌、乳腺癌和胰腺癌中表达上调,在正常细胞中低水平表达,阻断SLC6A14蛋白会影响肿瘤细胞内生物合成,而对正常细胞几乎没影响。Nicklin等发现,SLC1A5的抑制或缺失会导致肿瘤细胞内谷氨酰胺含量降低,mTOR信号通路不能被激活,最终肿瘤的生长受到抑制。
人体中有两种谷氨酰胺酶的亚型:肾型谷氨酰胺酶(GLS1)和肝型谷氨酰胺酶(GLS2)。在淋巴瘤、神经胶质瘤、乳腺癌、胰腺癌、非小细胞肺癌和肾癌的肿瘤细胞中,用小分子抑制剂或基因敲除抑制广泛表达的GLS1,产生抗肿瘤活性。在B淋巴瘤细胞和前列腺癌细胞中,高表达的致癌转录因子c-Myc可抑制miRNA-23a/b,上调GLS1的表达,增强谷氨酰胺代谢,促进肿瘤细胞的增殖。
在高度增殖的人乳腺肿瘤细胞中,转氨酶高表达,且转氨酶表达降低可有效抑制乳腺癌细胞的增殖。GDH可调节肿瘤细胞中α-酮戊二酸的产生,在肺癌和乳腺癌细胞中表达上调。在人肺癌H1299-异种移植肿瘤裸鼠中,GDH表达的降低可抑制异种移植模型中的肿瘤发生。谷氨酰胺代谢的中间产物参与信号转导。谷氨酸的代谢型谷氨酰胺受体mGlu(metabotropic glutamate receptors)的失活抑制ERK和PI3K信号通路,促进细胞自噬,导致肿瘤细胞死亡。抑制谷氨酰胺代谢的中间产物对信号转导通路的调节,有望治疗癌症。
抑制关键酶阻断谷氨酰胺代谢途径
目前不少针对GLS的抑制剂,具有抗肿瘤活性。双-2-(5-苯基乙酰氨基-1,2,4-噻二唑-2-基)乙基硫醚(BPTES)为选择性的GLS1变构调节剂,在体外抑制谷氨酰胺依赖性癌细胞的增殖,并减缓移植性动物肿瘤和致癌因子c-Myc驱动的小鼠肿瘤的生长。
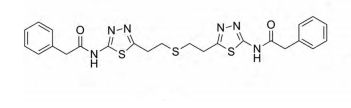
BPTES
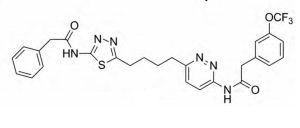
CB-839
目前正在进行临床Ⅰ期试验的CB-839,与BPTES具有相似的变构结合机制和选择性特征,但表现出更强的抑制活性和独特的动力学性质,是一种新型的GLS1变构抑制剂,具有良好的口服生物利用度。另外,CB-839在三阴性乳腺癌(TNBC)细胞系中具有抗增殖活性,在两种异种移植性肿瘤中显示出显著的抗肿瘤活性。从FDA批准的药物库中鉴定出的小分子化合物红紫素(purpurin),对纯化的GDH1有显著的抑制作用。对其优化后得到可进入细胞的红紫素类似物R162是有效的靶向GDH1抑制剂,能够提高癌细胞中的活性氧簇(ROS)水平,抑制异种移植性肺肿瘤的生长。
抑制谷氨酰胺的摄入
谷氨酰胺依靠细胞膜上的转运蛋白进入肿瘤细胞,抑制相关转运蛋白的表达可阻断谷氨酰胺的摄入,使肿瘤细胞缺乏能源物质,最终死亡。2012年,Oppedisano等鉴定了第一个结构中不含氨基酸片段的小分子化合物,可抑制谷氨酰胺的摄入。Schulte等人开发出首个强效靶向转运蛋白ACST2的小分子抑制剂——V-9302,并证实V-9302能够阻断ACST2蛋白的表达,从而导致癌细胞扩增减少、氧化损伤增加并最终引发死亡。且在体外和体内均呈现抗肿瘤作用。
最新研究发现,在骨肉瘤细胞和乳腺癌细胞中观察到,V-9302不抑制转运蛋白ASCT2,而是阻断钠中性氨基酸转运蛋白2(SNAT2)和大的中性转运蛋白1(LAT1),发挥抗肿瘤作用,并且在非洲爪蟾卵母细胞中重组表达SNAT1、SNAT2、ASCT2和LAT1得到确认。

V-9302靶向谷氨酰胺转运体的模型
靶向丝氨酸代谢
靶向丝氨酰胺代谢与调控途径丝氨酸从头合成途径(SSP)的改变是癌细胞中常见的现象。从糖酵解的中间代谢产物3-磷酸甘油酸(3-PG)开始,经过涉及3-磷酸甘油酸脱氢酶(PHGDH)、磷酸丝氨酸氨基转移酶(PSAT)1和磷酸丝氨酸磷酸酶(PSPH)调控的3个酶促反应产生丝氨酸。SSP中酶表达的升高是癌细胞在丝氨酸饥饿环境能够存活的因素之一。
PHGDH在三阴性乳腺癌和黑色素瘤细胞中的表达明显升高,且抑制PHGDH的表达能够导致肿瘤细胞的增殖率显著下降。PHGDH和PSAT1在非小细胞肺癌中激活,参与肿瘤的发生发展。另外,在高转移性乳腺癌细胞系亚型中PSAT1和PSPH高表达。丝氨酸为非必需氨基酸,抑制丝氨酸的从头合成,可能引起肿瘤细胞的耐受。
寻求外源性丝氨酸代谢中关键酶的抑制剂,为肿瘤治疗的新方向。外源的丝氨酸通过丝氨酸羟甲基转移酶(SHMT1或SHMT2)转化为甘氨酸,提供一个碳单元参与一碳循环,用于核苷酸生物合成。
在易患致癌因子Myc驱动的B细胞淋巴瘤的转基因小鼠中观察到SHMT1和SHMT2水平增加。SHMT2是人类肿瘤中最常表达的“代谢基因”之一,敲除SHMT2严重损害癌细胞的增殖。据报道,甘氨酸裂解系统(GCS)中的甘氨酸脱氢酶(GLDC)是非小细胞肿瘤中分离的肿瘤起始细胞中最上调的基因之一,抑制GLDC的异常激活可改善非小细胞肺癌患者的存活率。
目前,很多科研人员开始设计特异性的丝氨酸合成代谢的分子,实现对肿瘤的抑制。Pacold等使用高通量筛选鉴定了两种不同的PHGDH小分子抑制剂,其均能抑制丝氨酸从头合成,抑制癌细胞的生长。
靶向色氨酸代谢
靶向肿瘤细胞色氨酰胺代谢与调控途径哺乳动物细胞中,L-色氨酸(Trp)主要通过“犬尿氨酸途径”分解代谢,然后转化为L-犬尿氨酸(Kyn)。犬尿氨酸途径对Trp的分解代谢受3种不同的双加氧酶控制:色氨酸2,3-双加氧酶(TDO)、吲哚胺2,3-双加氧酶1(IDO1)和吲哚胺2,3-双加氧酶2(IDO2)。裂解产物N-甲酰基犬尿氨酸经酶促反应或自发水解成犬尿氨酸,IDO是催化“犬尿氨酸途径”L-色氨酸分解代谢的限速酶,并在多种人源肿瘤中高表达。
IDO通过消耗肿瘤微环境中对T细胞增殖至关重要的色氨酸,以及引起色氨酸代谢产物犬尿氨酸及其衍生物的积累,来抑制先天性和适应性的免疫细胞应答,导致肿瘤细胞的存活和快速增殖。IDO(IDO1和IDO2)在多种癌症中过表达,迄今为止专注于IDO1的研究。
临床前研究表明,在啮齿动物模型中靶向IDO1可引发抗肿瘤免疫反应,抑制肿瘤生长。TDO(一种同源四聚体血红素B蛋白)与IDO1、IDO2共同催化犬尿氨酸途径的第一步限速反应,但TDO对L-色氨酸具有比IDO1更高的亲和力。TDO通常在肝脏中表达,多在人肿瘤中高表达。临床前研究表明,TDO抑制剂能够促进宿主细胞对肿瘤细胞的免疫排斥,可作为一种安全有效的癌症治疗方法。
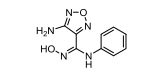
化合物A
1967年,IDO1被首次分离得到,且其天然底物L色氨酸在高浓度下能够抑制IDO1的活性,暗示色氨酸类似物可能具有抑制IDO1的活性。Incyte公司经过高通量筛选获得化合物A,研究表明化合物A对IDO1具有明显选择抑制性。同时,该化合物具有良好的配体效率,经研究评价后发现可作为良好的先导化合物。该化合物经系列优化后得到羟基脒化合物可作为IDO1的选择性抑制剂,促进T细胞、NK细胞的生长,抑制肿瘤细胞。在成功进行I期试验后,目前正在其针对各种恶性肿瘤进行Ⅲ期临床试验。百时美施贵宝(BMS)宣布的一种靶向IDO1抑制剂BMS-986205具有良好的药代动力学性质,且能够与其他免疫通路形成互补,更有效地激活抗肿瘤反应。目前,与PD-1抗体类药物Nivolumab的联合用药正在进行用于治疗黑色素瘤的临床试验。
靶向天冬酰胺代谢
哺乳动物细胞通过天冬酰胺合成酶(ASNS)从天冬氨酸和谷氨酰胺产生天冬酰胺。然而,一些癌细胞缺乏ASNS的表达,需要依赖血清中的天冬酰胺满足需要。目前,第一个直接靶向天冬氨酸代谢的抗肿瘤药物是来自大肠杆菌和欧洲野花欧文氏菌的L-天冬酰胺酶(L-ASPase),经FDA批准用于治疗儿科和成人急性淋巴细胞白血病(ALL)。L-ASPase广泛存在于微生物、植物和部分锯齿类动物血清中,经微生物发酵法生产得到的酶抑制剂。目前,许多临床试验正在评估L-ASPase治疗一系列恶性血液肿瘤的疗效。
靶向氨基酸代谢的药物作为个性化癌症治疗的组分,已经从临床前研究发展到临床试验, 并且在某些情况下显示出功效。相信随着分析代谢技术的进步, 研究者们将能够精准地选择合适的模型系统和识别目标患者, 并发现更多的靶向氨基酸代谢的新型癌症治疗药物。
将于今年10月11-13日召开的第二届上海国际癌症大会涉及CAR-T技术、新型肿瘤蛋白标记物、新型肿瘤甲基化标记物、ctDNA、CTC、癌症代谢重编程、代谢与肿瘤微环境、脂质代谢、代谢酶的非代谢功能、代谢与表观遗传、临床转化、肿瘤免疫治疗新技术、肿瘤免疫治疗临床应用、新兴靶向治疗等内容。欢迎大家来参会!
专家阵容请看:第二届上海国际癌症大会演讲嘉宾名单公布!
往届回顾请看:2018首届国际癌症大会盛大开幕

长按识别二维码,立即报名
现在报名,可享受八折优惠哦


