1. 乳腺癌化学预防
【2116】余科达教授:NSABP乳腺癌研究60年奥德赛之旅
2019年ASCO盛会于5月31日至6月4日在美国芝加哥召开。今年大会主题:Caring for Every Patient, Learning from Every Patient。值此盛会之际,《新见》栏目特邀乳腺癌领域专家学者共同推出六期ASCO-BC特刊,报道与点评乳腺癌领域热点。特刊第一期特邀复旦大学肿瘤医院余科达教授就 “NSABP clinical trials in early breast cancer: A 60-year odyssey” 展开精彩回顾与点评。
复旦大学附属肿瘤医院乳腺外科 行政副主任
复旦大学附属肿瘤医院乳腺外科 主任医师
国家优秀青年基金获得者
中华医学会肿瘤分会乳腺青年学组 主任委员
中国抗癌协会乳腺癌专委会 委员
中国抗癌协会肿瘤靶向治疗专委会 委员
中国抗癌协会青年理事会 理事
上海市抗癌协会青年理事会 副理事长
上海市抗癌协会乳腺癌专委会 常务委员/秘书长
上海市抗癌协会乳腺癌青委会 副主任委员
上海医学会肿瘤靶分子分会 秘书/委员
《新见》是由中华医学会肿瘤分会乳腺肿瘤青年学组主办的国际会议期刊文献解读与点评专栏。
古希腊荷马史诗《奥德赛》回叙了主人公奥德修斯(Odysseus)奇幻艰难的海上冒险故事,展现了大智大勇、不屈不挠的精神。在中国,公元前200多年,秦始皇命徐福率三千童男女东渡蓬莱,寻求不死神药。两千多年过去了,虽然科技进步一日千里,但人类平均寿命依然受制于百年。讽刺的是,人类机体中的一些细胞,在体内居住几十年后,通过基因变异和适应进化,跳脱了时间和空间的限制,成为病态的“永生化”细胞,具有无限增殖、任意游走的能力,即“癌细胞”。癌症,如阴影一般,从人的生命一开始就伴随左右;人寿命越长,发生基因突变和碱基错配的累积机会越高,癌症发生机会也就越大。
图1 奥德修斯受海妖歌声迷惑的情景,来自英国画家John Willam Waterhouse(1894-1917)
乳腺癌,位于女性恶性肿瘤发病率第一位,死亡数第一位。美国乳腺与肠道外科辅助治疗研究组(National Surgical Adjuvant Breast and Bowel Project,NSABP)是一个临床试验合作团体,其使命是设计并实施乳腺癌和结直肠癌的临床及临床前研究,旨在提高肿瘤诊疗和护理标准。NSABP 60年风云际会,在抗击乳腺癌道路上开启了一场波澜壮阔、前赴后继、传承不息的奥德赛之旅。
NSABP临床试验可追溯到1957年,当时一次会议上23名外科医生决定更好诊治乳腺癌而开展临床研究;1958年4月4日,第一名试验患者入组。此后,一项项研究如火如荼开展,成果如一阶阶“巨人肩膀”。牛顿曾以巨人肩膀比喻璨若星海的科学前驱,而NSABP一系列临床试验的脚下,是无数临床医生、科研人员、药物研发、以及患者和家属的通力扶持。今年ASCO会议主题演讲“NSABP临床研究,一场60年的奥德赛之旅”,回溯了60年辉煌而艰辛的历程。我从2004年起从事乳腺外科,对比NSABP的60年历程,所学所知,沧海一粟。按中国历法,60年为一甲子循环,借此时机,让我们来回溯、浏览、总结NSABP乳腺癌的里程碑式临床研究脉络。
以下将从四个板块,分述NSABP B系列(B代表Breast,乳腺)研究带来的深远影响。第一,当下乳腺癌“标准”建立的基础;第二,历史车轮之中,哪些研究被“淘汰”,哪些方向不断校正;第三,进入精准医学时代后,讲究个体化实施,NSABP如何盛放精准“拓展”之花;第四,已知越多,未知也越多,NSABP依然引领我们“探求”新领域。
一、吹尽狂沙始到金——“标准”
《黄帝内经》云:“上工治未病,不治已病。”古代中医哲学很大程度上与现代科学理念不谋而合。但,“治未病”也是最难的,既然“无病”、“未病”,又如何治,治什么?现代医学通过基础研究,揭示肿瘤发生发展的各个阶段,了解癌变机理,从而确立治癌前病变和控高危人群的理念,NSABP P-01和P-02奠定了乳腺癌药物预防的基础(P代表Prevention,预防)。
NSABP P-01试验以高危女性为对象(高危定义为根据Gail模型预判5年累计患乳腺癌风险大于1.66%,或曾患过小叶原位癌的妇女),研究他莫昔芬(20mg/天)5年能否有效降低乳腺癌发生。结果发现,他莫昔芬组较安慰剂对照组显著降低约50%的乳腺癌风险。但后续分析发现,他莫昔芬不能预防ER阴性乳腺癌,并增加了老年女性子宫内膜癌、栓塞、血栓等发病率。NSABP P-02(也称STAR试验)乘胜追击,证明雷洛昔芬在预防乳腺癌方面疗效与他莫昔芬相似,而毒副反应更小。这两个奠基性研究,确认了选择性雌激素受体调节剂(SERM)的化学预防价值,直到几十年后,芳香化酶抑制剂(AI)才进入化疗预防领域(依西美坦的MAP-3试验)。
早期预防研究有其不足:如目标人群挑选过于宽泛,大多数老年女性的5年患乳腺癌风险都会大于1.66%。因此临床实施时,医生无法把控哪些才是真正“值得预防”的女性。2019年最新TAM-01试验带来了新模式,该研究发现对DCIS、LCIS等乳腺上皮内瘤变患者,他莫昔芬5mg/天服用3年具有20mg/天服用5年相似的效果,为“有效、短程、低毒”的预防模式开启了一扇新大门。
2. 乳腺导管原位癌
导管原位癌(DCIS)是最早期的乳腺癌, 顾名思义癌变还局限在乳腺导管内没有突破基底膜,在国际AJCC分期中列为“0期”。DCIS是排他性诊断,只有全部标本中确认没有浸润成分,纯DCIS诊断才成立。外科局部手术是DCIS的重要治疗方式。NSABP系列研究解决了三个DCIS相关问题:
2.1 保乳手术后,要不要放疗?
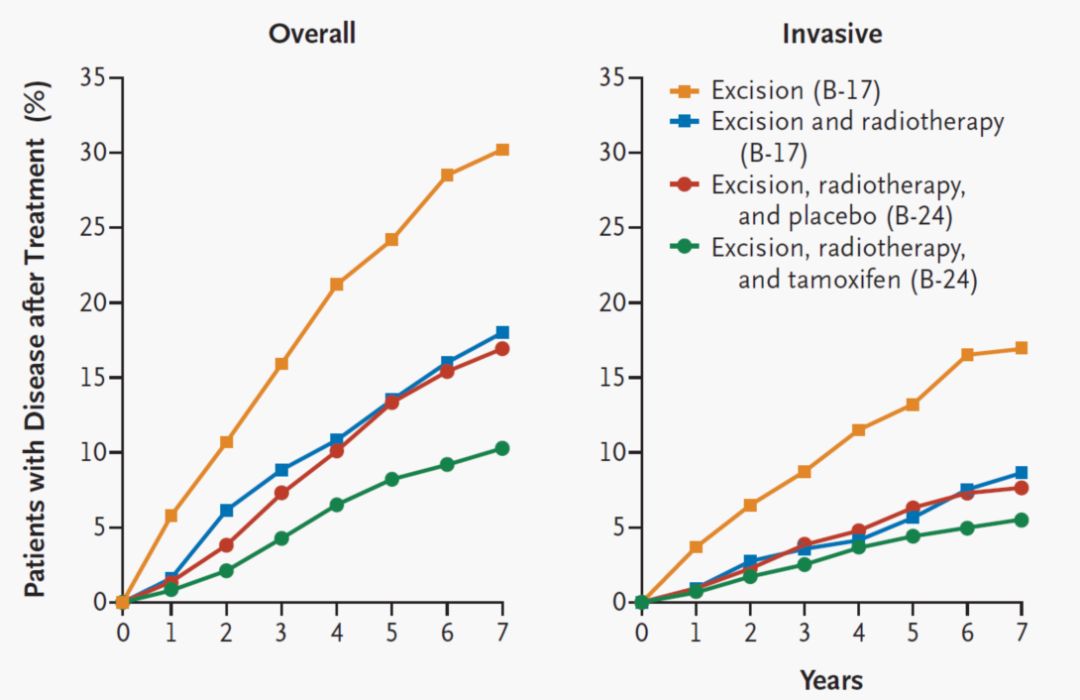
由于DCIS严重程度轻于浸润性癌,故保乳患者是否一定要放疗需进一步确认。NSABP B-17入组了病理诊断DCIS、接受保乳手术且切缘阴性的患者,随机接受保乳手术或保乳手术加全乳放疗,结果发现放疗使同侧乳房肿瘤复发风险相对降低60%,绝对获益达15%;不过总生存并未获益。
2.2 保乳+放疗后用不用他莫昔芬?
他莫昔芬是ER阳性浸润性乳腺癌降低局部复发和远处转移的重要方式,NSABP B-24证实了DCIS保乳术后辅助他莫昔芬治疗的价值。他莫昔芬比安慰剂降低了约30%浸润性乳腺癌和对侧乳腺癌发生率。B-17,B-24,以及UK/ANZ DCIS等研究共同确立了对ER阳性DCIS保乳患者,术后放疗与内分泌治疗都是重要的降低局部复发的措施。
2.3 保乳+放疗后,绝经后患者选AI还是他莫昔芬?
在浸润癌中,AI的疗效优于他莫昔芬,NSABP B-35由此在绝经后ER阳性DCIS保乳患者中分析AI的优势。试验人群接受5年的他莫昔芬或阿那曲唑,结果阿那曲唑组的10年无乳腺癌生存率显著优于他莫昔芬,绝对获益4%;亚组分析提示阿那曲唑主要对小于60岁的患者有效。两组毒性各异,主要是两药的已知毒副反应。而另一项相似设计的IBIS-II DCIS试验却则未能取得阳性结果,提示需要对相关结果综合考虑,荟萃分析。
综上,虽然临床医生对DCIS如何选择保乳、保乳后是否放疗等问题上争议不断,也有基于SEER的流行病学研究提出对低级别DCIS不用广切手术,笔者认为:(1)B-17奠定了DCIS放疗基础,B-24奠定了内分泌基础,临床上对DCIS患者,一开始的思路是保证两项治疗,然后基于疗效和毒性之间的权衡,根据患者实际情况做降阶选择。(2)重视DCIS原发灶的ER状态,并预判复发或新发病灶的ER状态。因为他莫昔芬对ER阴性乳腺癌没有预防作用,故对预判三阴性乳腺癌患者(如BRCA1胚系突变女性)不建议使用他莫昔芬预防。(3)对于绝经后小于60岁患者,AI可能是更有效的药物。(4)临床上可以采用Van Nuys预后指数(VNPI)等工具来协助判断DCIS切除范围和放疗与否,但鉴于VNPI尚未前瞻性证实,应是参考价值而非指导地位。
图2:NSABP B-17与B-24结果的联合展示,提示放疗与他莫昔芬是提高ER阳性DCIS保乳术后局控率的重要手段(N Engl J Med 2004;350:1430-41)
3. 外科及放疗
3.1 保乳+放疗是否与全乳切除相媲美?
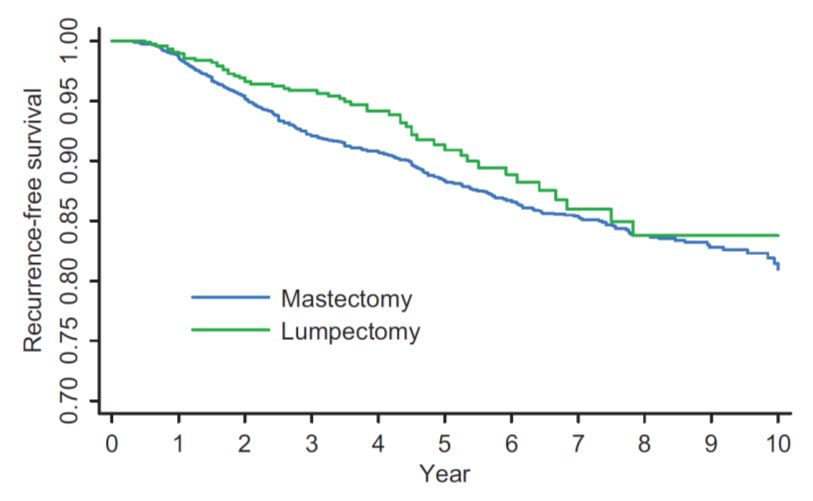
NSABP B-06入组了肿瘤小于4cm的I-II期乳腺癌,随机分成三组:单纯乳房切除术,保乳术,保乳+放疗。所有病人都行腋中下群淋巴结清扫。试验还规定:保乳后若同侧乳腺内肿瘤复发(IBTR),则不计入DFS事件。经过长期随访,保乳+放疗患者与全乳切除患者具有相似的DFS和OS。同时,放疗的加入,显著降低保乳术后肿瘤复发。B-06试验证实了保乳手术的可行性,也肯定了术后放疗的必要性;同期相似设计的Milan-I试验也重复了B-06的结果,两项研究于2002年在NEJM上发表20年随访结果,双星互耀,成为经典。以这些经验试验为基础,中国从90年代起开始尝试保乳治疗,目前上海肿瘤医院保乳率约30%,国内有些中心的数据还更高。经过术前严格评估和术中精确实施的保乳手术,安全性与全切相媲美。
图3:847例保乳与5288例全切生存率比较 (数据来自复旦大学附属肿瘤医院1998-2008年病例, 数据发表于Oncologist 2011)
3.2浸润性癌保乳人群能不能免除放疗?
保乳术后放疗能降低患侧肿瘤复发,研究者试图找出复发低危人群免除保乳后放疗。NSABP B-21试验入组了低危患者(肿瘤小于1cm且腋淋巴结阴性),接受保乳后随机接受他莫昔芬、或放疗、或者放疗+他莫昔芬。结果三组复发率分别为16.5%、9.3%和2.8%,提示术后放疗是必须的。2005年保乳后放疗的EBCTCG荟萃分析提示放疗能够降低70%的复发;2011年保乳EBCTCG荟萃分析更新了这一数据,局部复发相对获益50%,绝对获益16%,乳腺癌特异性生存绝对获益4%。但是,保乳后豁免放疗的探索没有停止,后续CALGB 9343和PRIME II等研究在老年、早期、ER阳性且内分泌治疗患者身上,找到了减免放疗的可能性。
3.3保乳患者应用加速部分乳腺照射(APBI)可行吗?
大规模APBI前瞻性研究NSABP B-39 (RTOG 0413)比较了早期患者保乳术后常规全乳放疗(WBI)与APBI的疗效及毒副反应,2018年圣安东尼奥乳腺癌大会公布数据提示:APBI相对于WBI的同侧乳房内肿瘤复发(IBTR)风险比是1.22,90%可信区间为0.94-1.58。由于非劣性设计要求90%可信上界要低于1.5,故未能达到研究终点。但两个治疗组的IBTR绝对差异仅为0.7%,说明对某些保乳患者而言,APBI仍是一种替代WBI的选择。
3.4 前哨淋巴结活检阴性能免于腋窝清扫吗?
随着乳腺外科保守理念的流行,不仅乳房能保留,腋窝也可以有条件地保留。NSABP B-32对前哨淋巴结活检阴性的患者,随机接受进一步清扫或放弃清扫,结果两组腋窝复发率、DFS、OS均无显著差异。该临床试验确立了前哨淋巴结活检阴性的患者避免腋清扫的标准。B-32这个先导性研究进一步拓展了前哨淋巴结微转移或宏转移患者免于腋清扫的可能性,如IBCSG 23-01(1-2枚微转移免于清扫)、ACOSOG Z0011(1-2枚宏转移的保乳患者免于清扫)、AMAROS(1-2枚宏转移患者,以腋窝放疗替代清扫)等试验后来居上,探索了更深层次的免于清扫的可能性。当前,研究者尝试对初诊腋窝淋巴结阳性患者,探索新辅助化疗后免于腋窝清扫的可行性;Z1071、SENTINA等研究结果提示在精选人群中(如TNBC/HER2阳性等高pCR分子亚型、取得3枚及以上前哨、双示踪等)可尝试新辅后前哨淋巴结活检。
图4:腋窝淋巴结免于清扫的临床试验变迁简史
3.5 手术切除局部区域复发灶后,怎么办?
乳腺癌术后若局部区域复发,切除复发灶后,有无再次辅助治疗必要呢?NSABP B-37(也称CALOR)试验评价了手术切除局部区域复发病灶后继续化疗的有效性。虽然没有入满目标人群数(预计977,实际仅入组162),但依然得到了DFS和OS的阳性结果,化疗组和非化疗组的5年DFS分别为69%和57%(P=0.046),提示再次化疗具有生存获益,且ER阴性组获益更显著。
4. 新辅助化疗和辅助化疗
化疗药物和方案的临床研究,是一个纷繁芜杂的网络。在众多化疗研究中,NSABP试验常常起到了奠基作用,如果缺少这些,不仅化疗选择逻辑变得毫无头绪,还可能改写药物与方案的进化方向。
4.1 化疗好还是不化疗好?
这表面上看起来只是药物给不给的选择,深层次是对Fisher理论(“乳腺癌是系统性问题,故需要系统性全身治疗”)的验证。NSABP B-05试验比较了淋巴结阳性乳腺癌患者术后化疗苯丙氨酸氮芥(L-PAM)给或不给的差别,结果证实化疗组的DFS显著提高,绝经前患者的获益更为显著。B-05的里程碑方向引导了后续若干临床试验。在此基础上,NSABP B-20继续在ER阳性、淋巴结阴性患者中探索化疗联合他莫昔芬与单药他莫昔芬的差别,发现即便是淋巴结阴性患者,化疗仍增加4-5%的DFS获益,确立了化疗不可或缺的独立地位。2005年EBCTCG荟萃分析总结性认定:单药化疗比不化疗降低14%复发风险(HR=0.86,P=0.001),多药化疗较不化疗降低了23%复发风险(HR=0.77,P<0.001)。
4.2 蒽环雪中送炭
随着新化疗药物的研发,蒽环进入研究者的视野。NSABP B-15比较了淋巴结阳性患者术后AC(阿霉素+环磷酰胺)*4疗程、CMF*6疗程及AC*4+CMF*3疗程方案的疗效,结果发现三组的DFS和OS没有显著差别。显然,AC较CMF更加方便,疗程很短,因此更优选。后续NSABP B-16试验比较AC方案和PAF方案(F:苯丙氨酸氮芥、A:阿霉素、F:5-氟脲嘧啶,PF/PAF曾是辅助化疗的标准)在淋巴结阳性患者中的疗效,两者依然没有显著差别,由于苯丙氨酸氮芥逐渐被淘汰,且PAF采用三药联合,故AC方案才是优选方案。NCIC-CTG MA.5等研究进一步证明CEF*6优于CMF*6。后续2005与2012年的EBCTCG荟萃分析确认了CAF/CEF*6>CMF*6=AC*4的排序,成就了蒽环作为乳腺癌辅助用药的基石地位。
CAF*6一度是乳腺癌辅助领域的万金油方案,但是近年地位受到挑战,甚至被踢出NCCN指南。究其原因,一方面,紫杉类的异军突起,使CAF*6不再是优选,含紫杉方案才是;另一方面,5-FU被彻底否定,GIM-2试验认为5-FU没有任何辅助价值;更重要的是,NSABP B-36在淋巴结阴性患者里比较了CEF*6与AC*4的差异,结果未能证实CEF的优势,反而毒性更大,生活质量更低。于是NCCN删除了CEF/CAF方案。但笔者并不认同,毕竟B-36是在淋巴结阴性患者里实施的,在中危和淋巴结阳性人群里,CAF依然有合适人群。
4.3 紫杉锦上添花
紫杉类加入蒽环类,是否能进一步增加疗效?NSABP B-28携手CALGB 9344等关键临床试验,交出了一份漂亮答卷。B-28中,淋巴结阳性患者接受AC*4疗程后,随机接受紫杉醇或不接受治疗,结果紫杉类降低了4%复发转移风险,相对获益17%。2012年EBCTCG荟萃一锤定音,蒽环基础上加入紫杉类能新增2%绝对获益和13%相对获益。
4.4 蒽环、紫杉相得益彰
从蒽环崛起,到紫杉风靡,多项研究(如PACS-01,BCIRG-001)显示出蒽环联合/序贯紫杉具有最佳的疗效。NSABP B-30正是一项在淋巴结阳性患者中评估蒽环紫杉联合用药的临床试验,分为三组:AC*4-T*4组,AT*4组,TAC*4组。结果AC-T相对于AT或TAC方案能显著提高DFS,与AT方案相比还能显著延长OS。由于BCIRG-005已经证实AC*4-T*4等效TAC*6,故从本研究可推测在高危人群中,TAC*6=AC*4-T*4>TAC*4,6周期对高危患者是必要的。出乎意料的是,AT*4(即蒽环+紫杉强强联合)在三组中“最差”,一方面可能是疗程和剂量不够;另一个潜在解释是AT引起的闭经率为75%,不如AC-T与TAC的90%以上,故不能带来“化疗内分泌效益”的间接获益。
4.5 既生蒽环,何生紫杉
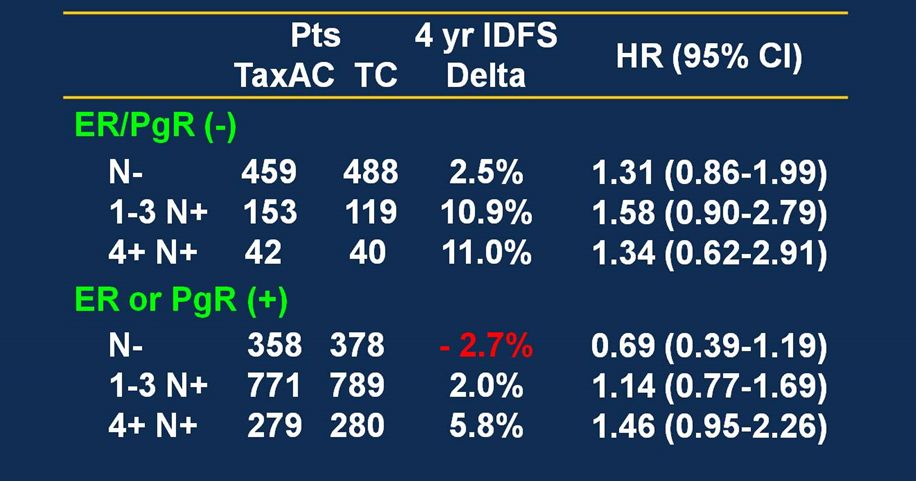
蒽环紫杉联合方案优于蒽环基础方案,而单药紫杉又优于单药蒽环(USO 9735试验中TC*4优于AC*4),那么蒽环紫杉联合方案与紫杉去蒽环方案相比又如何呢?目前已有几个临床试验回答了这个问题,如ABC联合分析、Plan-B、SUCCESS试验等;最引人注目的ABC联合分析综合了NSABP B-46、NSABP B-49、USOR06-090等三项设计相似的临床研究,试图证明TC*6方案非劣于蒽环紫杉联合方案。结果提示:对激素受体阴性、淋巴结阳性患者,蒽环紫杉联合方案有高达10%的生存获益;而激素受体阳性、淋巴结阴性患者,去除蒽环不影响疗效。因此笔者以为,包含还是舍弃蒽环,要根据患者复发风险、内分泌敏感性、预测化疗抵抗有否、及毒副反应等综合判断。
图5:ABC联合分析:按照ER/PR状态和淋巴结转移数目进行分层。TaxAC代表蒽环紫杉联合方案;TC代表去蒽环的紫杉+环磷酰胺方案。
5. 辅助内分泌治疗
5.1 应用5年他莫昔芬的获益?
辅助他莫昔芬,经历了明确人群(一开始不区分ER状态)、校正时间(一开始1-3年他莫昔芬)等过程,逐渐确立了ER阳性乳腺癌中5年他莫昔芬金标准。NSABP B-09这项奠基性研究评价了在ER状态混杂的淋巴结阳性乳腺癌人群中辅助他莫昔芬的疗效,一组接受PF化疗,另一组接受PF化疗联合他莫昔芬,结果他莫昔芬组DFS显著提高,并且DFS和OS的提高与ER状态密切相关。B-09奠定了淋巴结阳性患者中的他莫昔芬疗效,NSABP B-14按照相似的设计,奠定了淋巴结阴性患者中的他莫昔芬疗效。2005年EBCTCG荟萃分析得出5年辅助他莫昔芬降低了ER阳性乳腺癌34%的死亡风险,而3年以内用药仅降低18%;结合当时10年他莫昔芬数据不成熟,最终确立了5年他莫昔芬金标准。
5.2 应用10年他莫昔芬的获益?
在NSABP B-14第一阶段成功验证5年他莫昔芬的疗效后,研究者快马加鞭,继续设计实施第二阶段,满5年他莫昔芬的患者,一组继续服用他莫昔芬5年,另一组服用安慰剂,结果延长组不仅没有DFS获益还倾向降低了OS(P = 0.07)。这一反常结果可能与入组人群是低危患者有关。由于B-14的结果,使5年时长难以被推翻。一直到ATLAS和aTTom出来,10年他莫昔芬才被重新提及。ATLAS和aTTom入组人群不限淋巴结状态,虽然整组是阳性结果,但真正获益的是淋巴结阳性高危人群。而B-14发现的低危患者只要5年他莫昔芬便足够的结论,在今天看来都是正确的。毒副反应上,延长用药翻倍提高了子宫内膜癌发生率。
5.3 应用5年AI的获益?
NSABP研究在AI辅助领域的研究较为有限。ATAC比较了阿那曲唑与他莫昔芬,BIG 1-98比较了来曲唑与他莫昔芬,TEAM比较了依西美坦与他莫昔芬,而NSABP等非盈利组织很少涉及药物上市性研究。2015年EBCTCG荟萃分析提示5年AI优于5年他莫昔芬(EFS获益3·6%),AI成为绝经后ER阳性乳腺癌辅助内分泌首选策略。
5.4 延长使用AI的获益?
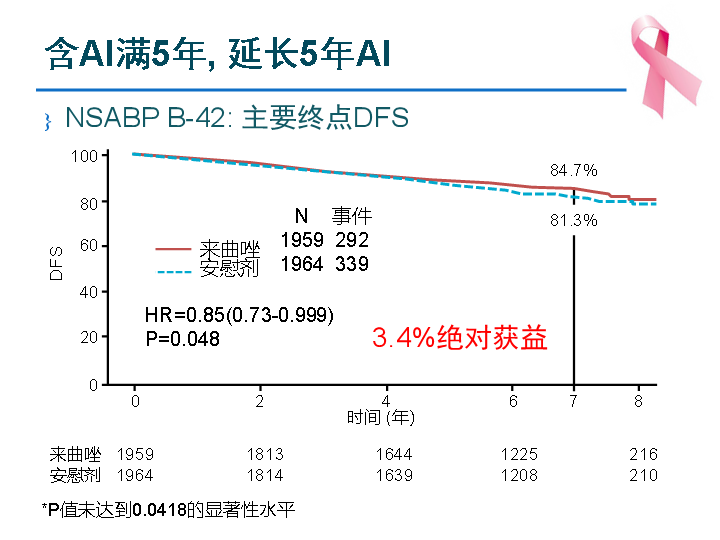
NSABP B-33分析了早期ER阳性乳腺癌在5年他莫昔芬结束后,延长依西美坦与否的问题。由于提前揭盲,安慰剂组40%以上患者改用依西美坦。即便如此,AI延长组仍显著提高了DFS。另一项NSABP B-42试验,研究绝经后ER阳性乳腺癌含AI治疗5年后,继续延长5年来曲唑的疗效。结果延长组在数字上而并非统计学上提高了DFS(P=0.048,但显著性P要求0.0418)。亚组分析显示前期使用过他莫昔芬的患者更能从延长AI中获益。上述临床研究,与DATA、IDEAL、SOLE等AI延长研究一起,说明了几个问题:(1)不建议全人群不加区分地延长AI,延长选择应慎重,权衡利弊;(2)建议对高危患者和前期他莫昔芬治疗者进行延长;(3)AI延长时间到底是2.5年,3年,还是5年,目前没有标准,总体是个体化决策。
图6:延长AI代表性研究NSABP B-42,发表于Lancet Oncol. 2019;20:88-99
图6:延长AI代表性研究NSABP B-42,发表于Lancet Oncol. 2019;20:88-99
6. (新)辅助抗HER2治疗
6.1曲妥珠单抗中心地位的确立
曲妥珠单抗是重组人抗HER2单克隆抗体,通过特异地结合癌细胞膜表面HER2蛋白达到特异性杀灭癌细胞的目的,开创了乳腺癌“生物靶向治疗”时代。全球范围内有至少6项临床试验(HERA、NSABP B-31、NCCTG N9831、BCIRG006、PACS04、FinHer等)研究曲妥珠单抗的辅助治疗价值。NSABP B-31研究中,患者随机分两组,一组是AC序贯紫杉醇;另一组AC序贯紫杉醇联合曲妥珠单抗。N9831设计与之类似,故一般将两者进行联合分析,曲妥珠单抗的加入,显著降低了40%的复发与37%的死亡。与单纯化疗组相比,曲妥珠单抗未显著增加严重心脏不良事件。
6.2 其他抗HER2策略的尝试和探索
HER家族包括HER1/2/3/4四个成员,HER2能与HER1或HER3形成异源二聚体传导下游信号,故需开发新药物进行下游联合抑制。拉帕替尼是一种针对HER1/2的小分子酪氨酸激酶抑制剂。新辅助NeoALTTO试验取得了鼓舞人心的结果:拉帕替尼联合曲妥珠单抗相对于单靶提高了20%的pCR率。之后NSABP B-41试图延续NeoALTTO的辉煌,设计比较在紫杉醇基础上加单靶(曲妥珠单抗,或拉帕替尼)或双靶(曲妥珠单抗+拉帕替尼)的差别。结果双靶相对单靶仅有数字上而非统计学上(P=0.095)的获益,绝对pCR获益不足10%。联合CALGB 40601、NeoALTTO,最终荟萃分析确认拉帕替尼提高的pCR客观获益约12%,但几乎所有拉帕替尼新辅助试验都按照NeoALTTO中20%的pCR差异来计算样本量,所以拉帕替尼大宗新辅研究全都折戟沉沙也不足为奇了。祸不单行,辅助ALTTO试验也因对药物疗效过于乐观,大量入组低危患者,导致阴性结果。至此,拉帕替尼再无进入辅助领域可能。与之相对,帕妥珠单抗具有截然不同的命运,先由NeoSphere研究确立了新辅助地位,然后稳扎稳打,由APHINITY确立其辅助地位。虽然帕妥珠单抗的绝对获益并不高(约2.0%),但通过遴选高危因素依然能找到高获益人群。
二、无可奈何花落去——“淘汰”
1. 乳腺癌腋窝处理的选择
NSABP早期开展过一些外科临床试验,虽然结果并未改变外科模式,但相关数据对今天而言是一笔财富。NSABP B-04试验比较了不同淋巴结状态下的不同外科处理的差异:(1)对腋淋巴结临床阴性(cN0)者:比较乳房单纯切除术、乳房单纯切除术+腋淋巴结放疗、以及单纯切除+腋窝清扫(即改良根治)三者疗效差异。(2)对腋淋巴结临床阳性(cN+)者,比较乳房单纯切除后,放疗与腋窝清扫的差别。经过25年随访发现:在cN0中,三种处理方式的OS均无显著性差异;在cN+中,腋清与放疗OS也无显著性差异。但是B-04并未改变临床实践,对cN+患者,腋窝清扫是临床医生更倾向的方式;对cN0患者,医生也很难放弃腋窝评估。
但是B-04的数据给了我们积极参考,如腋淋巴结阴性患者,进一步腋清发现仍有40%的患者有淋巴结阳性;若不加处理,腋窝复发率19%。这些数据提示评价腋窝淋巴结状态的必要性,也促成了后续NSABP B-32、Z0011等研究。事实上,OS是个让人又爱又恨的终点指标,OS只关心最后活得长不长,却不关心活得好不好。虽然B-04各组的OS是一样的,但再次腋窝清扫率、后续治疗率、以及生活质量,恐怕难以一致。
2. 老旧化疗方案
在NSABP B-05试验中看到左旋苯丙氨酸氮芥(L-PAM)的单药疗效后,NSABP B-07继续比较了乳腺癌术后单用苯丙氨酸氮芥(P)与联合应用苯丙氨酸氮芥和5-氟脲嘧啶(PF)的疗效。结果显示两组的DFS差别很小,但在绝经前、淋巴结转移较多患者中,联合用药优于单药。PF方案一度成为化疗标准,但随着NSABP B-16等试验(AC对比PAF)的结果出炉,AC成为一个更具吸引力的方案,同时L-PAM带来更高白血病风险,逐渐被淘汰。
3. 有临床意义的“阴性结果”
3.1 HER2低表达患者是否适用抗HER2治疗?
曲妥珠单抗的终端目标是HER2蛋白,研究者试图弄清HER2蛋白低表达患者是否抗HER2治疗也有效。该假设有参考先例,当ER是1-10%低表达时,仍有内分泌治疗获益。NSABP B-47试验对HER2低表达的定义为HER2免疫组化检测1+或2+且荧光原位杂交(FISH)阴性。这些HER2低表达、淋巴结阳性或高危淋巴阴性患者随机接受化疗+曲妥珠单抗或单独化疗,结果曲妥珠单抗未能带来生存获益,否决了对HER2低表达者使用抗HER2治疗的假设。
3.2 多药化疗是不是越多越好?
2005年EBCTCG对辅助化疗荟萃分析时,发现多药化疗(Polychemotherapy)是相对于单药化疗更好的选择,并确立了蒽环、紫杉、环磷酰胺三药联合的常规模式。那么再加入第四种药物,高危淋巴结阳性患者是否有新增获益呢?NSABP B-38进行了研究,在蒽环、紫杉、环磷酰胺三药联合(ACàP方案或TAC方案)基础上,加入吉西他滨(ACàPG),结果并未改善DFS和OS。可见不加限制的多药化疗似乎没有意义。但这个研究不能推翻其他药物获益的可能性。以CREATE-X为例,通过基于蒽环+/-紫杉的新辅助化疗筛选前期不敏感人群后,进一步卡培他滨强化治疗带来7%绝对获益,获益在TNBC中最显著;同样,CBCSG-010在TNBC辅助蒽环紫杉化疗全程中加入卡培他滨,也显著降低了复发转移(数据待发表)。
此处不得不提一个争议很大的临床研究,NSABP B-40,它有两层设计:一层设计是比较新辅助阶段加吉西他滨或卡培他滨能够改善pCR,是阴性结果,印证了B-38的数据,也一定程度上体现卡培他滨“强化”作用可能只在TNBC中更显著,而非对全人群都适用;另一层设计是比较新辅与辅助阶段均加用或均不用贝伐单抗(Bevacizumab),结果发现全程加贝伐单抗趋势性提高DFS并显著提高OS。虽然这个结果激动人心,但其他贝伐单抗辅助研究(ECOG 5103 [HER2阴性人群],BEATRICE [TNBC人群],BETH [HER2阳性人群])都是阴性结果,我们需要更多的数据来确认贝伐单抗的辅助地位。
3.3 氯膦酸盐出师未捷身先死
双膦酸盐在乳腺癌治疗中有防治骨破坏和抗肿瘤双重功效,从晚期向早期辅助领域拓展。氯膦酸盐是第一代双膦酸盐,它的辅助临床研究NSABP B-34整体是阴性结果,但在老年患者里具有预防骨转移的价值。可惜后续验证性研究基本遥遥无期了,因为第三代双膦酸盐如唑来膦酸、伊班膦酸都已上市而且也有成功的辅助用药研究,如ABCSG-12证明唑来膦酸能独立改善DFS、预防骨转移;ABCSG-18证实地诺单抗(Denosumab)带来DFS获益。如此一来,氯膦酸盐已是明日黄花。
三、雏凤清于老凤声——“拓展”
1. 多基因工具指导乳腺癌治疗
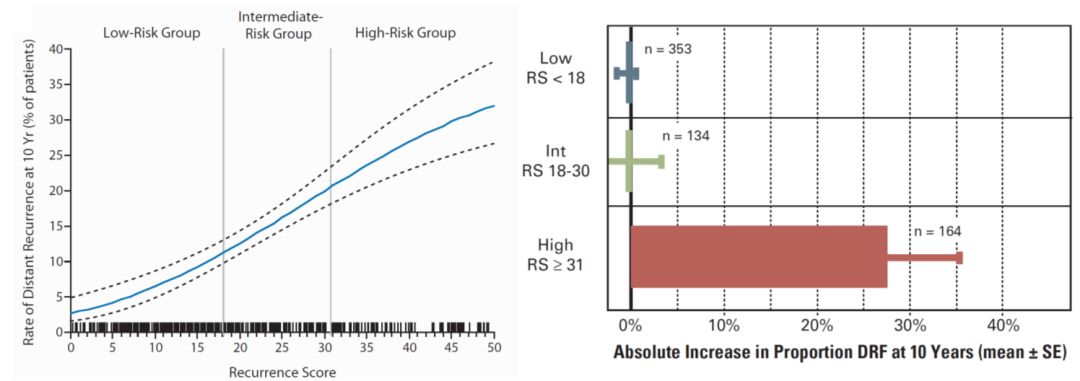
随着乳腺癌诊疗进入以基因工具为指导的精准医学时代,临床试验设计方面也带来革新,“一刀切”的老旧设计已一去不复返,结合个体分子分型以及基因标志群的设计成为主流,比如基于21基因(Oncotype DX产品)的TAILORx试验、基于70基因(MammaPrint产品)的MINDACT试验。21基因运用RT-PCR的方法检测肿瘤组织的ER相关基因、增殖相关基因、HER2相关基因,以及侵袭性相关等16个目标基因和5个内参基因,计算复发评分(RS)。21基因工具是否准确,首先要回顾性验证,通过后再前瞻性验证。回顾性验证中,两项NSABP试验功不可没。首先是NSABP B-14,证明了21基因的RS评分越高,10年转移风险越高。RS是连续分数,范围在0-100,<18表示低复发风险,18-31表示中风险,≥31为高风险。然后是NSABP B-20,证明了RS越高,越能从化疗获益,≥31时化疗绝对获益最大,中危时化疗价值不明。基于此,后续前瞻性TAILORx试验重点研究中危患者(前瞻性设计时,将原来18-31的中危评分保守地设定为11-25分),结果发现对中危患者,单纯内分泌治疗不劣于化疗内分泌联合组。但年轻的中危患者(如小于50岁且RS 20-25分)在豁免化疗时,仍需个体化考量。
图7:21基因(Oncotype DX)的开发验证基于NSABP B-14与20,左图通过B-14数据确立18与31分作为低危、中危、高危的分界;右图通过B-20数据确立对高危患者化疗获益显著,对中危患者化疗获益不明确。
2. 新辅助化疗 vs 辅助化疗
2.1 化疗与手术的先后顺序是否影响生存?
新辅助化疗是以手术为目的的术前化疗。局部晚期患者只能先行新辅助化疗;可手术者,化疗与手术交换顺序会影响生存吗?针对这个学术问题,NSABP B-18试验将入组的可手术乳腺癌患者随机分成两组:一组先AC*4周期化疗后手术,另一组先手术后AC*4辅助化疗,结果两组的DFS和OS没有统计学意义的差别。虽然先化疗的患者有更高的机会接受保乳,后续随访发现,那些新辅降期后保乳的大肿瘤(主要T2及以上)患者,似乎有更高的同侧乳腺内肿瘤复发率,2018年EBCTCG新辅助荟萃分析也警示了这一点。
新辅助化疗后获pCR的患者,相对于未达pCR患者,有更好的生存获益;不过这种生存获益,不是因为新辅助化疗而额外获得的,而是肿瘤本质属性的体现。通过新辅助化疗,我们只是提前看到了对化疗敏感和不敏感的两类人群,但是化疗本身并没有改变这种固有敏感性。
后续的NSABP B-27在新辅助AC*4周期的基础上,比较了三种情况:或直接手术,或继续新辅4周期多西他赛后手术,或直接手术后加4周期多西他赛。结果与B-18一样,不管是术前加还是术后加多西他赛,均不影响DFS和OS。这进一步从逻辑上确认:只要患者接受一样的治疗方案,不管术前给还是术后给,对生存均没有本质影响。
2.2 基于新辅助化疗结果的辅助治疗 vs 传统辅助化疗
新辅助化疗通过术前治疗,反映体内药物敏感度,从而指导患者后续治疗。目前有两种模式:
一种是新辅助方案边做边调整模式。至少有三项新辅助试验(GeparTrio、UK-Aberdeen、MDACC研究等)研究了先做新辅助2-4疗程后,根据治疗反应调整后续新辅助的用药。
另一种是新辅助结果指导术后辅助方案模式。对已完成全部新辅助化疗、仍有残余病灶的患者,调整后续用药(如KATHERINE和CREATE-X研究)。KATHERINE研究(即NSABP B-50)显示,对HER2阳性的非pCR患者,辅助使用 T-DM1 与曲妥珠单抗相比,疾病复发转移风险降低50%,绝对获益11%。T-DM1是曲妥珠单抗与DM1(美登素,一种微管抑制剂)的耦合物,其不良事件发生率高于曲妥珠单抗组,3级以上毒副反应以血小板下降最为常见。CREATE-X与NSABP B-50等研究在带来更多希望的同时,也带来一些深思:CREATE-X的强化药物是化疗药卡培他滨而非靶向药物,NSABP B-50本质上也是追加了化疗药DM1,而没有选择拉帕替尼、帕妥珠、来那替尼等抗HER2药物。所以KATHERINE和CREATE-X本质上是“不断换化疗”的逻辑,只是把前期证实为低效的化疗药,转换为另一种疗效不确定的化疗药而已。通过新辅助化疗,寻找到敏感靶点吗?没有;有揭示新辅助疗效不佳的原因呢?也没有。因此,想通过新辅助治疗找到“敏感性药物”,还有很长的路要走。
四、吾将上下而求索——“探求”
1. HER2阳性对DCIS的治疗价值
HER2阳性的DCIS约占DCIS的50%,主要表现为粉刺样病理特征、组织学分级高、易伴有微浸润。虽然曲妥珠单抗是治疗HER2阳性浸润性乳腺癌的重要靶向药物,但在HER2阳性DCIS中的疗效不明确。正在开展的NSABP B-43试验拟阐明HER-2阳性DCIS在保乳术后是否有必要联合曲妥珠单抗提高局控率。具体用法是在放疗同期曲妥珠单抗治疗4周(每3周使用,共2次)。前期入组数据发现HER2在DCIS中的阳性率为35%,低于先前报道,主要研究终点尚待公布。
2. 依维莫司(Everolimus)与奥拉帕尼(Olaparib)的辅助地位
NSABP正实施多个临床研究,目光投向了转移领域取得较好疗效的药物,如依维莫司与奥拉帕尼。
NSABP B-53是一项III期随机、安慰剂对照的临床试验,研究高危、激素受体阳性、HER2阴性的早期乳腺癌患者在内分泌治疗基础上,加入一年依维莫司能否带来生存获益。依维莫司是mTOR抑制剂,mTOR是很多肿瘤通路的最后一道关口。依维莫司相关口腔粘膜炎、腹泻等副反应发生率在30%以上,一年辅助用药对毒性管理是一项挑战。NSABP B-55这项III期、双盲、安慰剂对照的临床试验则研究在胚系BRCA1/2突变的高危HER2阴性乳腺癌患者中,在(新)辅助治疗全部结束后,口服一年奥拉帕尼的有效性和安全性。
未来
一方面,分子生物学技术迅速发展,不仅基因检测、二代测序、多组学技术等“飞入寻常百姓家”,而且新兴单细胞测序等技术也是降价可期,我们认识乳腺癌生物特性有了更多武器。
另一方面,乳腺癌诊疗也越来越细化,“同病异治”和“异病同治”理念也逐渐形成,如BRCA1/2突变病、三阴性乳腺癌内部分子分型等,都体现了我们对肿瘤的认识越来越精细,乳腺癌不再是一种疾病,也不是4-5类分子亚型疾病,而是基于肿瘤分子表达、基因突变、通路异常的一系列多维度分子网络异常疾病。
未来将形成几方面的研究趋势:(1)外科多元化,如冷冻治疗、介入治疗、前哨淋巴结豁免研究等;(2)当前的晚期一二线药物进入辅助领域,如CDK4/6抑制剂、氟维司群、PARP抑制剂等进行辅助试验并出结果;(3)基于前期设计良好的临床试验标本和队列的转化性研究,如组学分析、多元网络分析,和大数据解读;(4)某些领域的爆发性发展,如免疫治疗,基因遗传咨询,和新型药物投递系统等。中国乳腺癌的临床和转化研究专家们,也将与NSABP等国际组织的科学家一起,共同推动乳腺癌诊疗发展。NSABP这一场60年奥德赛之旅,悲壮光荣,一路向前,只有前方,没有终点……
敬请期待《新见》ASCO-BC特刊
第一期:
复旦大学肿瘤医院余科达教授:NSABP clinical trials in early breast cancer: A 60-year odyssey
第二期:
北京大学肿瘤医院邵彬教授:Biomarker analysis of the APHINITY trial
浙江省肿瘤医院郑亚兵教授:Genomic markers in the PALOMA-3 trial
第三期:
广东省中医院大学城医院陈前军教授:Adjuvant Targeted Therapy: When Is More Better?
中山大学肿瘤预防中心史艳侠教授:TALA in Breast Cancer
第四期:
福建省立医院叶松青教授: GeparOLA: A randomized phase II trial
吉林大学第一医院宋东教授:Biomarkers in BC: BRCA/HRD/PD-L1
第五期:
武汉同济医院李兴睿教授:What is the role of surgery in metastatic breast cancer?
天津肿瘤医院王忱:CDK4/6 inhibitors:Optimizing Care in ER-positive Breast Cancer
第六期:
中国医科大学附属第一医院徐莹莹教授:Breast Cancer: 40 years of Research and Progress &Emerging system therapies:What’s new in 2019?
精彩回顾
【新见】徐莹莹教授&邢鹏教授:剂量密集型化疗在靶向治疗时代的价值