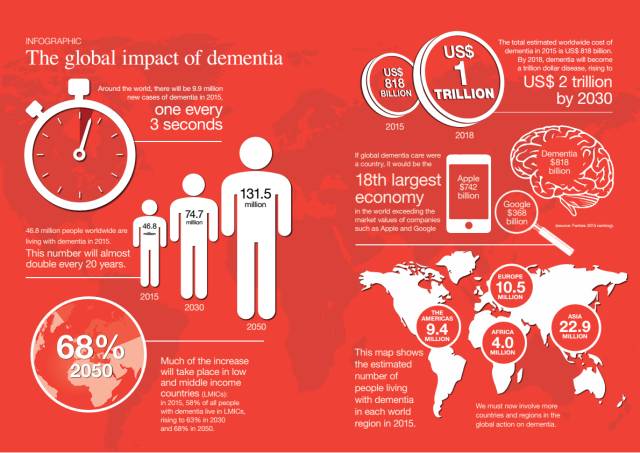
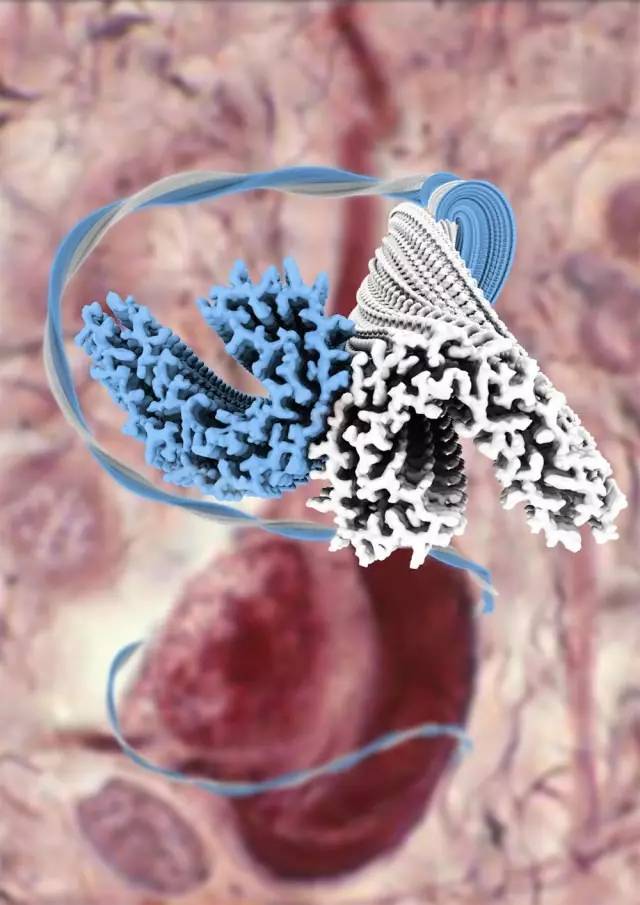
虽然这些病理特征上的认识,并不能作为疾病最原始的发生机制,但是人们起码形成了一个共识,就是阿尔兹海默病患者的脑中出现了非正常的蛋白质积淀。如果能够想办法靶向消除β淀粉样蛋白或Tau蛋白,也许就能够有效治愈阿尔兹海默病,起码能够改善一下病情。
基于这样的一个假设,生怕落后于人的各大制药公司,不惜投入数十亿美元,争先恐后开发靶向β淀粉样蛋白或Tau蛋白的药物。由于机制认识上的不足,也导致目前的这些药物,没有一种能够有效治愈阿尔兹海默病,甚至都无法控制和延缓病情发展。极个别获得批准上市的药物,也只能在一段时间内帮助减轻部分症状。
和这些药企做法不同的是,仍有一群科学家在默默继续着对Tau蛋白的研究。MRC分子生物学实验室的神经生物学主任Michel Goedert,这三十年来一直在与Tau蛋白打交道。
自从1988年他们首次发现阿尔兹海默病与Tau细丝的关系之后,1992年他们又发现了阿尔兹海默病患者脑部Tau蛋白的6种异构体,均由双螺旋丝(PHF)和直丝(SF)构成,长度分别在352-441个氨基酸;1998年,他们发现Tau蛋白基因MAPT的突变,会导致神经退行性病变和痴呆症;2009年,Goedert团队在转基因小鼠中证明了Tau蛋白的聚集会导致朊蛋白类疾病[6]。
但是,Michel Goedert表示,“到目前为止,人脑组织中Tau高分辨率的结构仍然是未知数。”也就是说,这么多年来科学家们还不知道Tau细丝真实的分子结构,那些开发Tau靶向药物的制药公司,原来是在黑暗中狂奔,不停地设计新药,然后不停地测试不同药物对Tau蛋白结构的影响。搞半天,是在拼运气么。
而且以前研究使用的Tau细丝,是从实验室合成的样品。鉴于Tau细丝多样的结构,这些之前研究使用的样品,与阿尔兹海默病患者脑部的Tau细丝对疾病的影响相差几何,更不得而知。
在结构化学中,有一句常讲的话叫做“结构决定功能”。如果无法确定Tau蛋白及细丝各种亚型准确的分子结构,也就无法针对性地设计抑制剂,阻止患者神经元中Tau细丝的形成。
研究人员尝试过X射线晶体成像和核磁共振技术,但这两种技术对样品条件的要求比较高,面对Tau这种独特而又复杂的样品,实在有点无能为力。研究人员将最终的希望放在了当下最火热、最先进的冷冻电子显微镜(Cryo-EM)身上。由于Tau细丝有着平滑的螺旋结构,确定螺旋结构内核的原子分布确实难度不小[7]。
为此,团队还开发了一套叫做RELION(REgularised LIkelihood OtimisatioN)的程序,来对冷冻电镜的数据进行分析计算,从而推断Tau内部的原子排列。最终,研究人员获得了Tau蛋白3.4-3.5Å(长度单位,1 Å =1×10-10米)分辨率的分子结构照片。