BioRxiv|机器学习结合高内涵预测PROTAC有丝分裂毒性
针对嵌合体的蛋白水解(PROTACs)使用泛素-蛋白酶体系统来降解感兴趣的蛋白质,以达到治疗的目的。在BioRxiv发表的文章“Cell morphological profiling enables high-throughput screening for PROteolysis TArgeting Chimera (PROTAC) phenotypic signature”中,作者使用细胞绘画(cell painting),一种无偏见的高内涵成像方法,来识别PROTAC的表型特征。确定评估和更好地了解PROTAC安全风险的可靠途径。
细胞绘画实验(Cell Painting assay,高内涵)可以作为一种高通量的成像分析方法来描述PROTACs诱导的形态学改变。事实证明,单元格绘制描述符足以训练具有良好预测性能的模型。作者证明了这些图谱可以用于PROTAC的线粒体毒性预测,强调了基于图像的数据可以用于监督和非监督机器学习方法,并为化合物的安全性评估提供信息,例如线粒体毒性,这与药物磨损和后期市场退出有关。
形态特征分析检测PROTACs活性
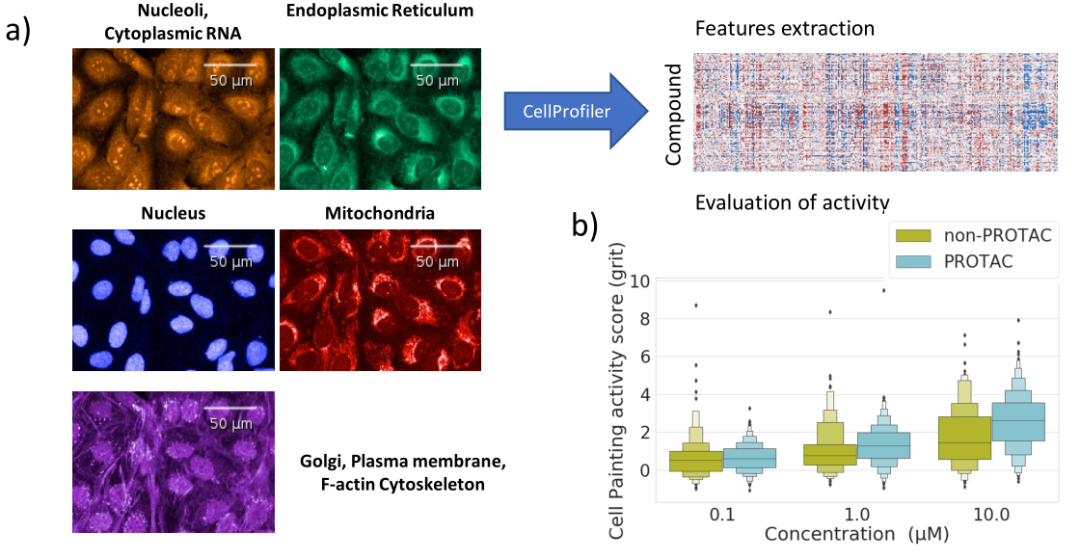
研究工作流程可分为四个主要步骤(图1a)。用U-2OS细胞涂色实验鉴定PROTAC。总共对341个PROTAC和149个非PROTAC进行了分析,这些PROTAC针对超过15个不同的靶标。用(细胞绘画实验(Cell Painting assay,高内涵)对化合物进行分析,用CellProfiler计算其形态特征。形态特征被归一化,并应用特征选择过程。最后,评估PROTACs在细胞绘画实验中的活性,并将 PROTACs-细胞绘画特征用作训练计算机有丝分裂毒性模型的描述符。
图1:单元格绘制工作流程和PROTAC活动。
a)本工作中执行的分析总结。PROTACs和非PROTACs化合物用细胞涂抹试验进行分析,然后进行数据归一化和下游分析。b)所有浓度(0.1、1和10μM)的细胞涂抹活性分数以砂粒分数的形式表示。PROTACs和非PROTACs化合物在细胞涂色实验中的活性(以颗粒分数的形式)都随着浓度的增加而增加。
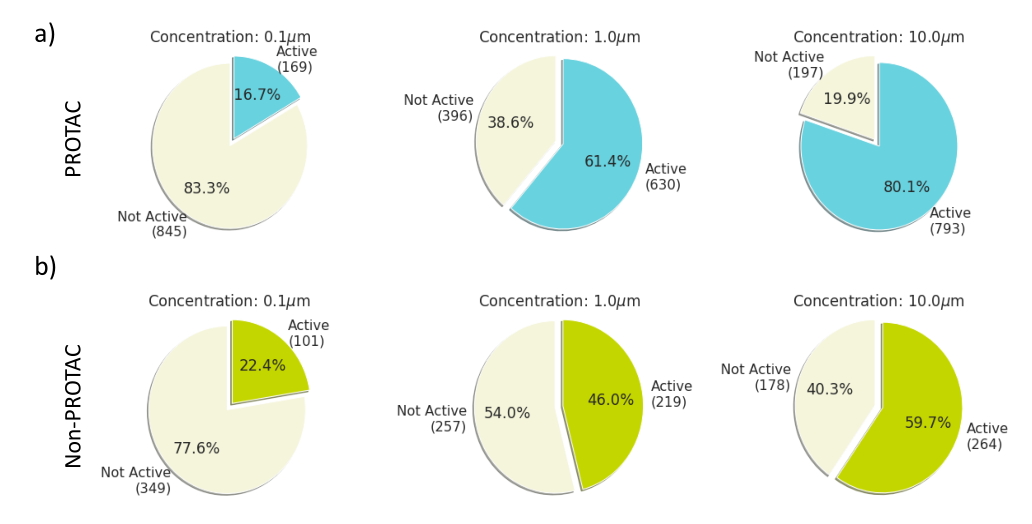
欧几里德距离法的结果表明,在检测浓度分别为0.1、1和10µM的PROTAC获得的~1,000(每个PROTAC 3个重复)剖面中,17%、61%和80%的剖面显示出与中性对照不同的细胞形态(图2a)。在直线上,随着浓度的增加,砂砾得分也越高(图1b)。对于非PROTAC化合物,也观察到了类似的趋势,在总共约450个轮廓中,有22%、46%和60%显示出与对照组不同的细胞形态(图2b)。同样,随着浓度的增加,砂砾得分也越高(图2b)。在这里检查的数据集中观察到了明确的剂量-反应关系。
图2:基于欧几里得方法的单元格绘制分数。
a)PROTACs和 b)非PROTACs化合物在基于欧几里得的方法的细胞涂色实验中被鉴定为活性的化合物(即能够改变细胞形态的化合物)在浓度为0.1、1和10μ时所占的百分比M.欧几里德距离法显示活性化合物的数量随着浓度的增加而增加。
另一个主要观察结果是,PROTAC化合物的活性并不总是与单个PROTAC组分的活性相关。PROTAC是双功能分子,包含靶标的粘合剂和E3连接酶的粘合剂,两者通过接头连接在一起。
细胞绘画投影显示不同的PROTAC签名
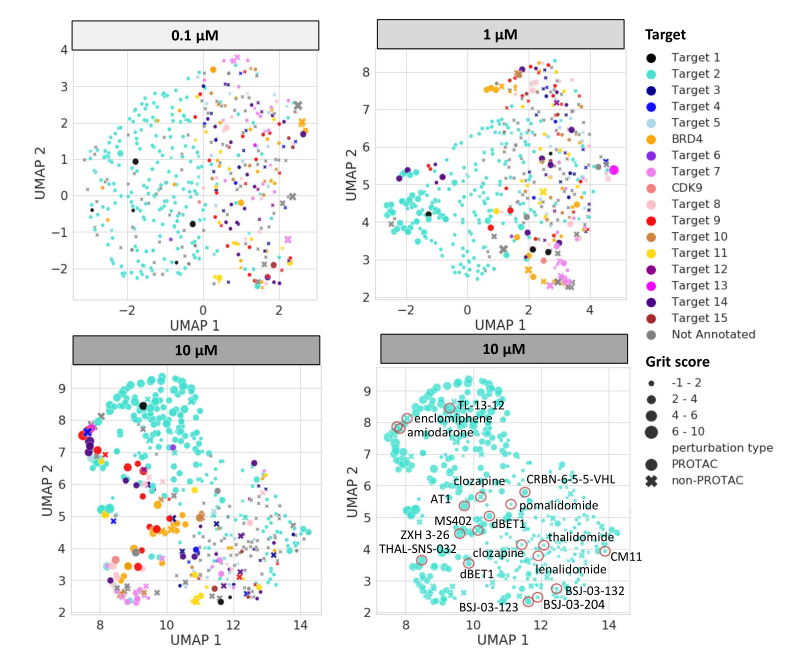
接下来,使用UMAP对PROTACs-细胞绘制简档进行降维,以了解使用该方法使用细胞简档读数将哪些表型响应聚集在一起。此分析的结果如图3所示,它为以不同目标为目标的PROTAC提供了一系列不同的、可区分的细胞绘制签名。此外,化学聚集随使用的PROTAC浓度和细胞涂刷活性得分(1vs10µM)而变化。小分子抑制剂MS402与针对PROTAC的BRD4聚集在一起,表明了类似的作用模式(图3,橙色注释)。
图3:统一流形近似(UMAP)分析。
UMAP分别在0.1、1和10µM的浓度下与标记有蛋白质的所有扰动配位,该蛋白质分别被每个非PROTAC或PROTAC化合物抑制或降解。已发表的PROTAC或非PROTAC化合物在UMAP绘图中注释为10µM
细胞绘画抹特征能够检测到线粒体的活动
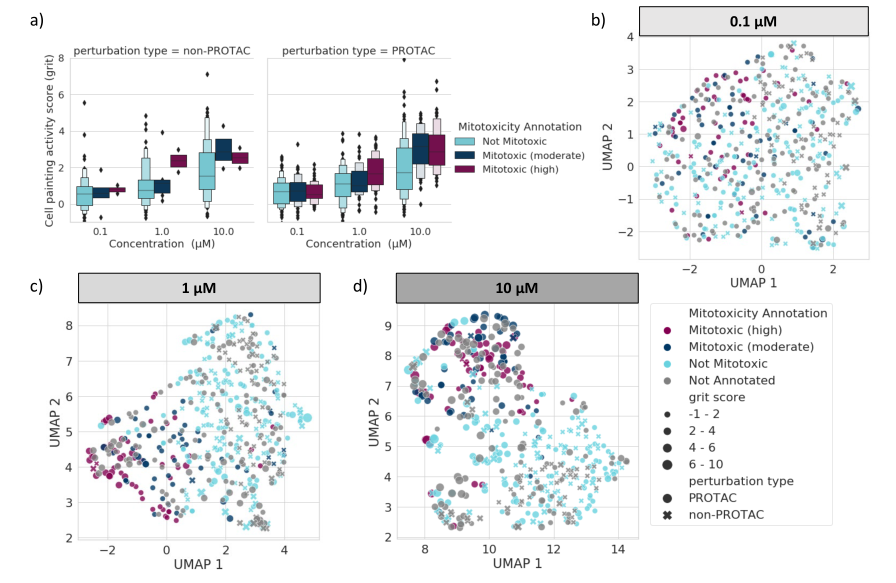
为了研究细胞绘画(Cell Painting)图谱是否可以用来评估PROTAC的安全性,作者采用了体外有丝分裂毒性的注释,这些注释可用于化合物集的一部分。从Glu/Gal试验中提取了PROTAC和非PROTAC化合物的线粒体毒性注释。在本实验中,细胞在两种不同的培养基中生长:生长在高糖培养基中的细胞利用糖酵解产生ATP,并能抵抗线粒体的伤害。在含半乳糖的培养基中生长的细胞几乎完全依赖线粒体产生ATP,因此对线粒体的伤害非常敏感。有丝分裂毒性化合物会引起不同的表型变化,这些变化可以通过细胞涂色试验发现,这可能被用来区分有丝分裂毒性化合物和无有丝分裂毒性化合物。
图4:线粒体毒性测定终点的细胞涂抹活性。
a)在0.1、1.0和10.0µM的浓度范围内,以砂砾分数的形式表示细胞涂抹活性分数,并根据线粒体毒性检测终点进行标记。在浓度 b) 0.1、c) 1和d) 10µM处用丝裂毒性注释标记的所有扰动的统一流形近似(UMAP)坐标。
机器学习模型对线粒体毒性的良好预测
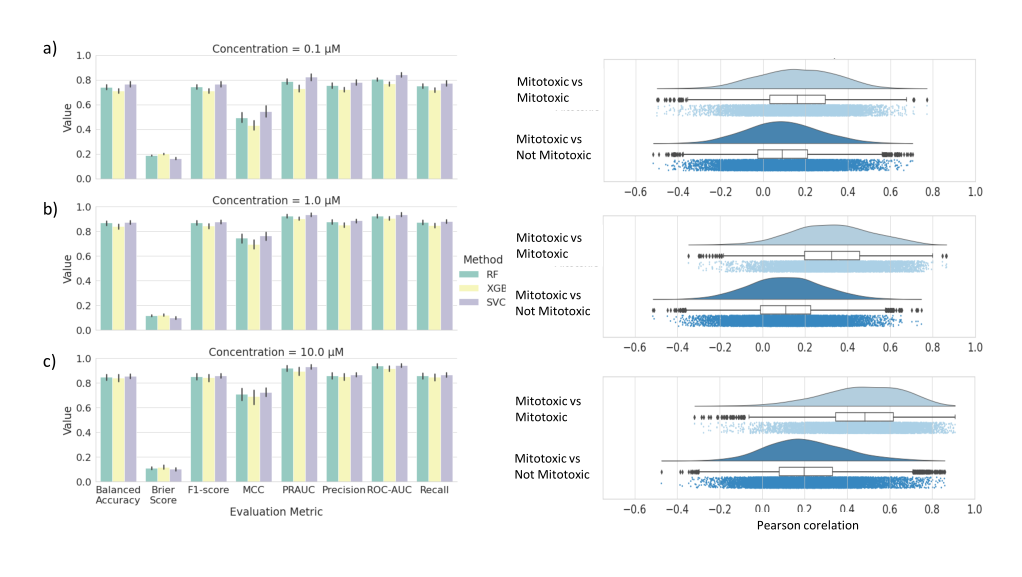
为了研究细胞绘画(Cell Painting )轮廓是否可以作为In-silo机器学习模型的描述符,用于线粒体毒性预测,用随机森林(RF)、支持向量分类器(SVC)和极限梯度增强(XGB)三种不同的算法对模型进行训练。模型评估结果如图5所示,为了进一步验证性能不是随机的,通过应用y-置乱来评估模型的性能是否优于随机模型。相似性分析进一步解释了为什么使用浓度1和10µM比使用浓度0.1µM的模型性能更好。
图5:线粒体毒性预测模型的性能。使用细胞绘制功能和三种不同的算法(a)10、b)1和c)0.1µM的RF、XGB和SVC预测线粒体毒性性能。误差条对应于用于交叉验证的所有分裂和随机状态的置信区间。类内(丝裂毒性vs丝裂毒素)与类间(丝裂毒性vs非丝裂毒性)的图像特征的皮尔逊相关性显示了每种浓度。
PROTACs作为一种新的治疗手段,需要对这些bRo5化合物进行分析。因此,在这项工作中,基于细胞涂抹实验可以定量研究PROTAC的形态学影响的假设,本工作利用细胞涂抹实验对来自不同项目的一系列PROTAC和非PROTAC化合物进行了描述。两个不同的指标,基于欧几里得距离和砂砾评分,揭示了PROTACs和非PROTACs的轮廓与中性对照不同,因此细胞涂色试验能够捕捉到PROTACs诱导的形态学变化。此外,基于欧氏距离的方法和GRIT评分显示,随着化合物浓度的增加,细胞涂色实验中活性化合物的数量增加,表型效应增强。
PROTACs在细胞绘画实验(Cell Painting assay)中的活性不仅仅是其各部分的总和。此外,在使用UMAP对PROTACs-Cell绘制轮廓进行降维后,能够了解是否以及哪些表型反应被聚集在一起,因为它们被降级了。结果表明,PROTAC针对不同的目标,如BRD4,有一系列不同的和可区分的细胞绘制签名。观察针对BRD4的特定化合物,小分子抑制剂MS402与针对PROTAC的BRD4聚集在一起,这表明了类似的作用模式。
意义
作者评估了PROTAC是否可以用高内涵试验进行分析。还评价了细胞绘画实验(高内涵)获得的细胞形态学特征是否可以作为PROTACs的描述指标来预测线粒体毒性。结果表明,PROTACs可以诱导细胞形态的改变,这一点通过欧几里德距离和GRIT评分两种不同的度量方法得到了证实。此外,在线粒体毒性预测模型中使用了PROTACs-Cell Paint Profile作为描述符,得到了高性能的模型。最后,模型在预测PROTAC的预期验证集的活性方面表现出了良好的性能。这一发现为如何利用这种分析的读数更好地理解这种新的数据模式创造了一个新的假设。
参考文献
Cell morphological profiling enables high-throughput screening for PROteolysis TArgeting Chimera (PROTAC) phenotypic signature
微信交流群