冷冻电镜在分子生物物理学中的技术革命
2017年诺贝尔化学奖授予来自瑞士洛桑大学的Jacques Dubochet,美国哥伦比亚大学的Joachim Frank以及英国剑桥分子生物学实验室的Richard Henderson,表彰他们“开发在溶液中测定生物分子结构的高分辨率冷冻电镜”。很多媒体评论说:“一个发给了物理学家的诺贝尔化学奖,奖励他们帮助了生物学家。”那么,冷冻电镜是如何在三门学科中融合,促进生物物理的革命呢?
作者:朱亚南,张书文,毛有东(北京大学物理学院 北京大学定量生物中心)
1 冷冻电镜技术的发展历程
结构生物学是通过解析生物大分子的三维结构等生物物理方法来研究其结构和功能的关系,进而理解生物大分子作用机制的一门学科。迄今为止,应用最广泛的结构生物学技术是X射线晶体学,但是该技术要求研究对象是能够结晶的蛋白质,不能结晶的蛋白解析难度较大,成为其发展过程中的瓶颈。另外,核磁共振波谱学技术不需要其研究对象形成晶体,而且能够达到原子分辨的水平,但是该方法仅适用于分子量较小的蛋白质、核糖核酸(RNA)或者它们的结构域。对于一些大型复合体、完整的膜蛋白、聚合物以及大分子组件,由于多种构象或者不同结构共存,这些“传统”方法的应用受到了限制。
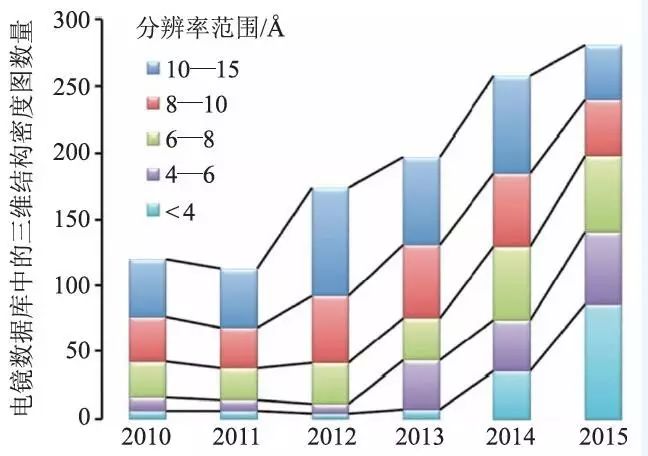
单颗粒冷冻电镜技术是近几十年来发展比较迅速的一种生物物理和结构生物学方法,可以用来解析尺寸比较大的蛋白复合体以及细胞器的三维结构。该方法不需要蛋白质分子形成晶体结构并且仅需要相对较少量的生物样品,通过快速冷冻可以获得生物大分子的天然状态。近年来,硬件和软件的发展使得单颗粒冷冻电镜可以得到近原子分辨率的生物大分子结构,极大地提高了冷冻电镜的应用范围。另外图像采集以及数据处理的效率较之前都有了很大的提高,越来越多的高分辨大分子结构通过该技术被解析出来(图1)。
图1 近几年来电子显微镜数据库(Electron Microscopy Data Bank,http://emdatabank.org/) 中电镜三维结构密度图数量的增长
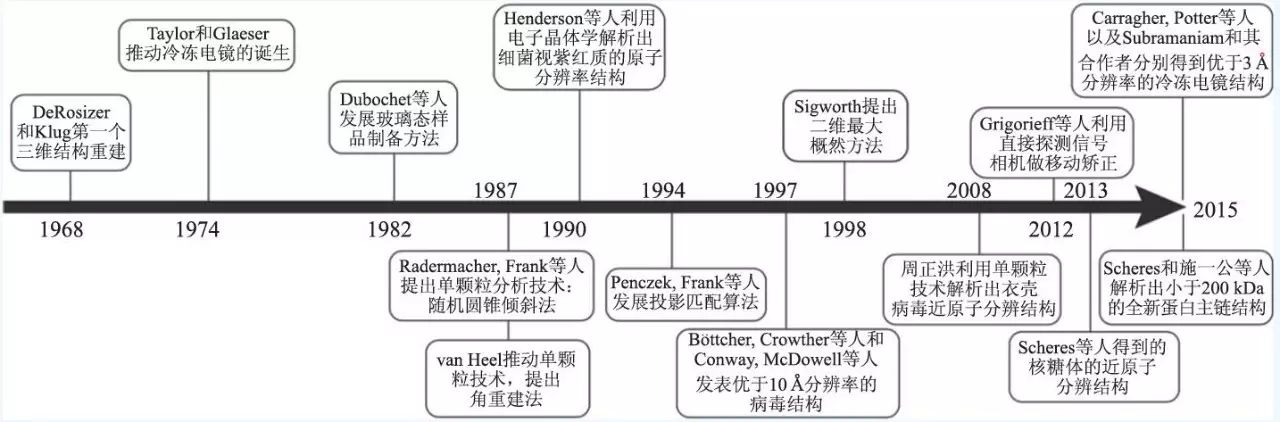
透射电镜(transmission electron microscopy,TEM)可以观测到分子水平的生物样品。TEM图片代表所观测的样品在不同朝向上的投影,这些投影可以通过特定的算法对样品进行三维重建。早在1968 年,DeRosier 和Aaron Klug 利用傅里叶—贝叶斯原理将分子各个朝向的投影结合起来,得到了T4 噬菌体尾部的三维结构,标志着电镜三维重建技术的诞生。但是,由于生物样品本身所具有的特殊性,存在三个方法上的瓶颈,从而限制了冷冻电镜技术的发展:第一,生物样品中含水量较高,而透射电镜要求样品处于高真空的状态下;第二,高能量的电子会对样品造成损坏;第三,生物样品主要组成是碳、氢、氧等轻元素,对电子的反射及散射与水背景相比效果相近,获得的电镜图像衬度反差很小。因此,早期电镜三维重建技术的发展主要集中在解决这些基本问题上。
早期对于这些问题的解决方案主要是负染色技术,即将生物样品置于重金属盐负染液中染色,一些常用的负染液有钼酸铵、乙酸铀酰、甲酸铀酰、磷钨酸等电子密度高的物质,它们可以嵌入生物样品的间隙,根据其产生的对比进行电镜观察和三维重构。由于负染液是重金属盐,这不仅可以解决生物分子遭到辐射损坏的问题,同时可以提高图片的对比度。但是,样品经过负染以后会丢失很多高分辨的信息,在许多情况下分辨率只能达到15 Å左右,也就是说只能观察到生物分子的基本形状,一些细节信息没法获得。1974 年Ken Taylor 和Robert Glaeser 发现冷冻样品可以保持蛋白质的高分辨信息。这个工作标志着冷冻电镜应用于生物物理学领域的开始。随后,Dubochet 等人发展了一套切实可行的玻璃态样品的冷冻方法,加上当时人们对于低温技术已经掌握得比较成熟,使得冷冻电镜这个领域得到了广泛的应用和推广。
图2 三维冷冻电镜发展史的时间轴
早期三维重建方法的发展大多是针对螺旋样品、病毒和二维晶体来进行的。值得一提的是,Richard Henderson 等人在二维电子晶体学上的开创性工作,使得细菌视紫红质(bacteriorhodopsin)的原子分辨率结构得以解析,该结构在七螺旋G蛋白耦联受体的同源模建中有着较长时间的应用。Henderson 将电镜图片和二维晶体的衍射图样结合起来,这个工作的困难之处在于一方面要将样品倾斜来获取不同朝向的投影,另一方面又要求产生平整的二维晶体。晶体通常情况下只有一个蛋白的厚度,这项工作是非常困难的,因此只有极少数的结构可以通过电子晶体学的方法得到解析,一小部分能达到原子分辨率。当然也有许多具有重要生物功能的蛋白质原子模型通过该方法解析出来,比如植物的捕光复合物和微管蛋白,以及1.9 Å分辨率的水通道蛋白0 型。电子晶体学的好处在于,它可以在天然的膜环境中研究完整的膜蛋白,比如细菌视紫红质和水通道蛋白0型等。
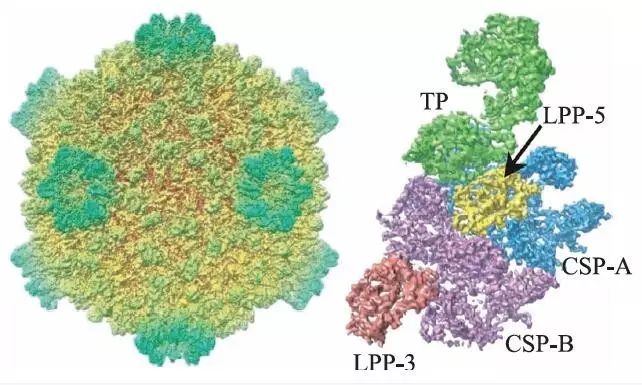
为了使三维冷冻电镜技术成为一个应用广泛的技术,而不是仅限于对规则的螺旋结构或者晶体阵列样品进行研究,生物物理学家们需要发展新的算法和重建策略。Joachim Frank 等人将大量具有随机朝向的样品放于金属网格上进行电镜拍摄,提出了处理单个大分子复合物(即“单颗粒”)样品的方法。他们的工作引领了单颗粒重建技术的诞生和发展,是今天冷冻电镜领域广泛使用的大分子结构解析方法的基础。2008 年加州大学洛杉矶分校的周正洪教授利用CPV(cytoplasmic polyhedrosis virus)病毒衣壳正二十面体的高度对称性,通过一万两千多张单颗粒图像,成功获得了3.9 Å分辨率的三维结构(图3),这是第一次通过单颗粒冷冻电镜重构技术得到近原子分辨率的结构。有关单颗粒分析算法的内容将在下一节中着重进行介绍。
图3 CPV衣壳整体结构(左图是利用对称性重构得到的衣壳复合体结构;右图为衣壳蛋白结构单元)
自2013 年以来,冷冻电镜取得了革命性的进步,其中最主要的原因之一是电子直接探测器(direct electron-detector device,DDD)的发展。DDD可以直接探测电子信号,而不像电荷耦合器件(charge-coupled device,CCD)需要利用光电效应记录数字信号,从而大大提高了信号的转换效率,提高了信噪比。2013 年10 月加州大学旧金山分校程亦凡教授研究组成功利用新一代DDD相机(Gatan K2 camera)拍摄了近九万张单颗粒图像,解析得到了瞬时受体电位(TRP)通道蛋白(TRPV1)四聚体的3.4 Å分辨率的结构。TRP通道是广泛存在的细胞和环境信号的传感器,但是一直缺乏精细的结构而无法揭示它们对物理和化学刺激信号的响应机制。这项研究打破了不结晶膜蛋白侧链的分辨率屏障,展示了单颗粒冷冻电镜在膜蛋白分析上的巨大潜力。
单颗粒冷冻电镜研究的一个关键问题是发展高效的计算工具来确定每张二维投影图片对应的投影方向角,进而进行三维的重建。为了减少电子对生物样品的辐射损伤,在实验上通常采用低剂量的电子(~20—40 电子/ Å2)进行照射,导致单张电镜图像的信噪比非常低。为了获得更高的信噪比,一般需要对几十上百张甚至上千张图片(DDD探测器出现之前需要更多的图片)取平均值来消除噪声的影响。现在已经有多种计算方法可以用来确定每张电镜图片所对应的方向角。Frank和Penczek 发展了一种“投影匹配”的方法。在进行“投影匹配”时,每张电镜图片与初始的参考模型在不同方向上的二维投影基于互相关系数进行一一比对,相关性最高的即认为是该投影方向为电镜图片所对应的实际投影朝向。还有一种方法是由Marin van Heel 提出的基于“公共线”
原则的几何方法。经过傅里叶变换之后,任意两张图片在三维傅里叶空间中都拥有一条公共的经过三维中心的线,基于这个原则可以确定每张图片对应的空间方向角。以上这些不同的分析方法已经被开发成了一系列的软件包,比如Spider,EMAN(EMAN2), Frealign, SPARX 和Xmipp等。
单颗粒冷冻电镜是针对单个粒子进行重构的技术,而我们的研究对象往往是多构象或者具有结构异质性的蛋白。这是一些蛋白质无法获得高分辨结构的重要原因之一。对于结构异质性样品的分析,我们需要先将样品分成几个同质的子集,然后分别进行三维重建。通常的做法是基于几何的方法获得不同的初始模型,然后利用多个参考模型进行投影匹配,进而进行三维重建。一个很重要的研究进展是由Fred Sigworth 提出的最大似然(maximum-likelihood,ML)方法。在ML实现过程中,每一张图片并不对应一个确定的相对方向角,而是会给出该图片在各个方向角上的概率的集合作为似然函数。这种方法可以有效地减少冷冻电镜图像中的噪声的影响,已经被用于处理生物样品中不同构象共存的问题,提高了识别和表征不同功能态的能力,为分析生物大分子的动力学提供了一定的依据。目前Frealign 和Xmipp已经融入了最大似然的原理,而Scheres 开发的软件包RELION因其对异质性样品的处理能力和友好的用户界面引起了全世界的关注,同时也使得单颗粒冷冻电镜图像处理得到了更广泛的应用。
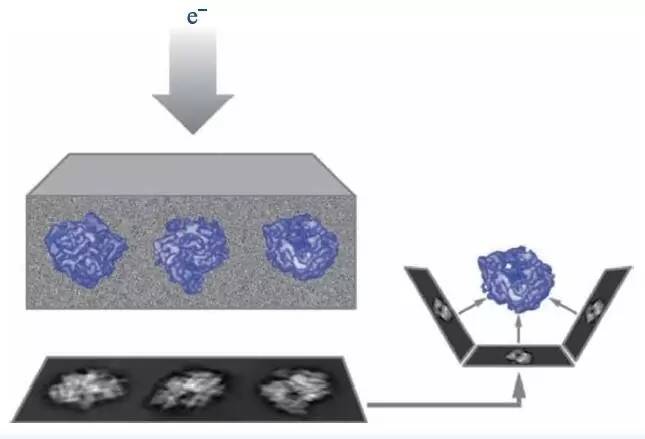
图4 单颗粒冷冻电镜技术原理图
目前一些先进的机器学习方法也被引入到了冷冻电镜的图像处理中来,并取得了突破性的进展。比如我们实验室基于卷积神经网络算法开发的用于自动识别单颗粒的方法(DeepEM),提高了单颗粒识别的精度和效率;将现有的最大似然方法同产生式拓扑映射(GTM)算法结合起来,开发了一套非监督式的图像二维分类算法(ROME2D),实现了二维多分类的突破;在数学上,流形是高维空间中的几何体,如高维曲线或曲面。这一概念为高维空间中的连续介质和复杂几何体的拓扑描述提供了一套完整的数学框架,因此具有描述蛋白质动态结构的潜力。流形学习是机器学习的一个前沿研究方向,本质是通过找到高维空间中的低维流行和相应的嵌入映射,来实现维度约减和数据可视化,从而找到产生数据的内在规律。基于流形学习的三维结构动力学分析最近也取得了一些非常有趣的结果。目前,多构象蛋白的三维分类问题以及生物大分子的动力学分析仍然是充满挑战的研究方向,新兴的算法的发展也将主要围绕这些问题展开。
先天免疫,又称非特异性免疫,是生物体免疫系统的重要组成部分,包括一系列非特异性抵御外来病原体入侵的细胞及相关机制。其中,炎症反应(发炎)是先天免疫系统移除有害刺激或病原体以及促进损伤组织修复的重要防御措施。炎症复合体(inflammasome,或称炎性小体)是一种存在于胞浆内的蛋白质多聚体复合物,在激活和维持炎症反应的过程中起到了关键的信号转导效应器或接头蛋白(adaptor protein)的作用。它可以招募、活化胱天蛋白酶caspase-1、caspase-5 等蛋白质水解酶, 促进白细胞介素(interleukin,IL)-1β、IL-18 等促炎性细胞因子的成熟,进而诱发细胞焦亡(pyroptosis,不同于细胞凋亡的一种细胞程序性死亡),从而调节免疫应答和炎症反应,抵御病菌侵袭。炎症复合体的失调也与一些自发炎症或自体免疫疾病相关,如2 型糖尿病、动脉粥样硬化等代谢疾病,多发性硬化、阿尔茨海默病等神经系统疾病。研究炎症复合体的结构和生化机理对于认识先天免疫的信号转导过程、免疫调控以及病原诱导活化等免疫响应机理具有十分重要的意义,因此成为了结构生物学和免疫学领域中的一个非常热门的研究课题。
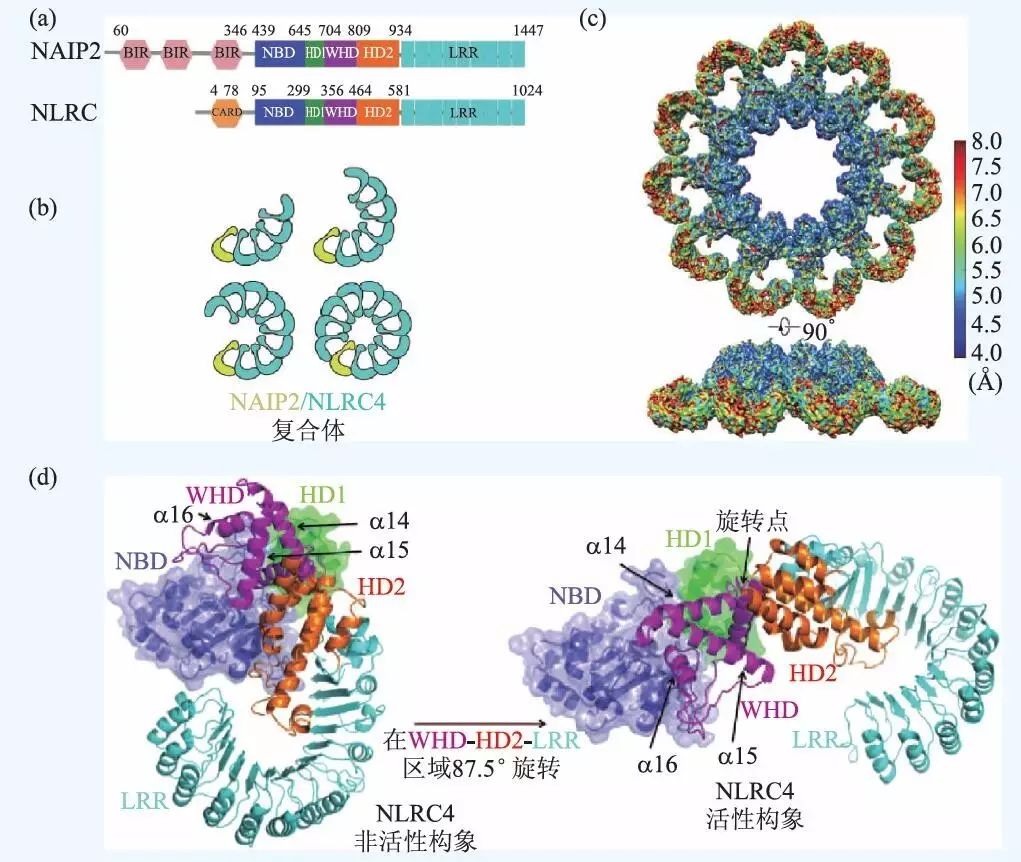
对于不同炎症复合体的结构和组成,目前已经有了很多研究。核苷酸结合寡聚化结构域蛋白(nucleotide-binding oligomerization domain,NOD)样受体(NOD-like receptor,NLR)是一种胞内模式识别受体蛋白,可以识别病原体相关分子模式(PAMPs)或者宿主产生的有害成分,并通过激活和寡聚化装配形成炎症复合体。如图5(a)所示,NLR 主要由3 个基本结构域组成:(1)位于NLR分子C端的富含亮氨酸的重复序列(leucinerich repeat,LRR)结构域;(2)位于NLR分子中央的NOD结构域:包括核酸结合结构域(nucleotidebinding domain,NBD)、螺旋结构域1(helical domain1,HD1)、翼状螺旋结构域(winged-helical domain,WHD)、螺旋结构域2(HD2),是NLRs寡聚化和活化的关键区域;(3)位于NLR分子N端的效应结构域:可以是蛋白质募集并活化Caspase结构域(caspase activation and recruitment domain,CARD), 也可以是PYD 结构域(pyrin domain,PYD)。通常情况下NLRs通过C端的LRR结构域维持在一种自抑制的状态。
在NLR 蛋白质家族中, NLR 凋亡抑制蛋白(NLR family apoptosis inhibitory proteins,NAIPs)是迄今为止唯一具有特定配体的家族成员,比如NAIP2 可以识别细菌T3SS 棒状蛋白,包括鼠伤寒沙门氏菌PrgJ,NAIP5 和NAIP6 可以识别细菌鞭毛蛋白,如鼠伤寒沙门氏菌FliC。NLRC4(NLR family CARD-containing protein4) 是NAIPs 的接头蛋白,在对PrgJ 或者FliC 的响应中参与caspase-1 的激活和IL-1β 的分泌。研究表明,病原体诱导激活后的NLRC4 会利用NAIPs 组装成具有11 或12 重对称性的盘状复合体,但始终缺乏高分辨率的结构分析。由于炎症复合体分子量巨大,且高度的构象异质性和动态性使得它难以结晶,所以传统的结构分析方法(如X射线晶体学和核磁共振等)都难以奏效。
在2015 年Science 杂志上发表的两篇文章中,研究人员利用冷冻电镜技术对PrgJ-NAIP2-NLRC4炎症复合体的结构进行了分析,并揭示了NLRC4激活后的构象变化以及自动组装的分子机制。其中一篇文章展现了更高分辨率的复合体三维结构,文章中利用冷冻电镜数据分析的新算法,通过并行统计机器学习,实现了对细微动态构象的深度分离,从而提取出了高度纯化的炎症复合体单颗粒图像的数据集,使得高分辨三维重建成为可能。最终得到的10 重、11 重、12 重对称性的10 聚体,11 聚体和12 聚体复合物的分辨率分别达到了7.5 Å、4.7 Å、12.5 Å,10 重对称性的10 聚体即为有10 个单体呈中心对称形成的复合体。其中11 聚体的电子密度图如图5(c)所示。另外,文章中根据11 聚体的密度图构建了原子结构模型,从而证实了炎症复合体通过单向聚合作用组装成多亚基盘状结构的过程。如图5(b)所示,一个被PrgJ 激活的NAIP2 可以通过NBD 和LRR区进行分子间作用,激活一个NLRC4 并与之寡聚,被激活的NLRC4 可以催化下一个NLRC4 并继续寡聚化,最终通过多米诺骨牌一样的反应,完成复合体的组装。突变实验证明,NAIP2 的激活作用是保守的,只能催化NLRC4,因而一个激活状态的NALP2 分子就足以触发整个复合体的组装,这与凋亡体Apaf-1 的装配过程是不同的,Apaf-1 在组装成七聚体之前每个原聚体都需要被激活。更加有趣的是,NLRC4 在从抑制状态变为激活状态的过程中发生了明显的构象变化,如图5(d)所示。对比抑制状态下的结构,NLRC4 在被NALP2 激活后, C 端的一部分(WHD-HD2-LRR) 会以WHD 区的一个α 螺旋为轴进行90°左右的铰链旋转,这一巨大的结构改变使得分子的催化表面和受体表面显露出来,从而促进聚合。已经有研究表明,铰链区附近发生的突变会造成严重的自发炎症疾病,足见这一高度动态化的区域在结构和功能上的重要性。
图5 NAIP2-NLRC4 炎症复合体的冷冻电镜三维结构及组装过程 (a)NAIP2 与NLRC4 蛋白质分子的结构组成,图中标注了各个结构域的名称和残基序号;(b)NAIP2-NLRC4 复合体的装配过程图示;(c)11 聚体的冷冻电镜结构,上下两图分别为俯视图和侧视图,图中颜色表示局部分辨率;(d)单个NLRC4 分子被激活时发生的构象变化图示,图中NBD-HD1 区域以连续剖面图和透明面的形式做了展示,WHD-HD2-LRR区域只有连续剖面图
在真核细胞中,成熟的mRNA并非单纯经过DNA转录就可以产生,还需要经过转录后的加工修饰过程。对于编码蛋白的基因来说,被称为内含子的非编码区和被称为外显子的编码区间隔排列, 初级转录之后产生的核内不均一RNA(hnRNA),即mRNA的前体(pre-mRNA),依然含有比例巨大的内含子序列。要想得到能够正确编码一个完整蛋白的成熟mRNA分子,就需要借助于被称为剪接体(spliceosome)的大型复合体将内含子切除,并将外显子拼接起来,这个过程称为剪接。
剪接体包含约150 种蛋白质和5 种RNA,大小和核糖体差不多。这5 种RNA 是相对分子质量较小(106—185bp)的核小RNA(snRNA)U1,U2,U4,U5 和U6,可以与某些核蛋白组成复合物,称为核小核糖核蛋白(snRNP)。剪接体就是由这些snRNP 形成的巨型复合体,但每种snRNP执行的任务不同, 因此在剪接反应的不同时期,剪接体中含有不同的snRNP,以及一些与其松散结合的不属于snRNP 的蛋白质。蛋白质和核酸分子会按照高度精确的顺序进行结合和解聚,使剪接体发生大规模的结构重组,依次组装成命名为E,A,B,Bact,B*,C,P,ILS 等等的一系列大分子复合物,从而实现不同的功能,如识别剪接位点,催化转酯反应等。由于剪接体成分复杂多变,构象高度动态,所以有关剪接体组装及催化过程中各复合物的结构生物学研究是最基础也是最具挑战性的生物学难题之一。
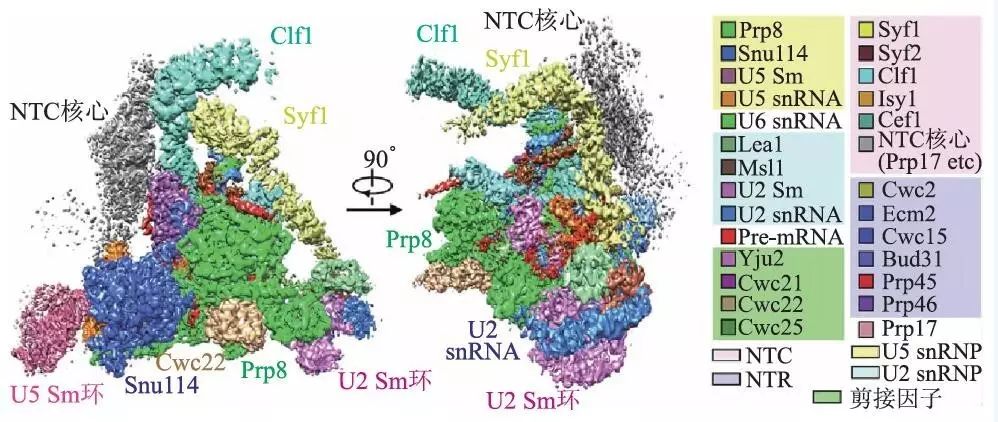
关于剪接体的研究已经持续了几十年,尤其是近几年,随着蛋白质纯化技术以及三维冷冻电镜技术的发展,对剪接体结构的研究取得了卓有成效的进展,各个状态的复合体很多都推进到了10 Å以内的分辨率水平。比如清华大学的施一公团队2016 年在Science 上发表了3 篇文章,分别针对芽殖酵母剪接体预组装复合物(U4/U6.U5 tri-snRNP)以及处于激活状态(Bact complex)和第一步催化反应后(C complex)的剪接体复合物,解析它们的三维结构,使得它们的平均分辨率都达到了4 Å以内,并且搭建了这些复合物的原子模型,探讨了催化反应的分子机制。图6 展示的便是C complex 的冷冻电镜结构,平均分辨率为3.4 Å。此外,2015 年他们还解析了裂殖酵母剪接体在ILS 状态的高分辨结构。除了酵母以外,也有一些研究对人类剪接体的结构进行了冷冻电镜高分辨解析,并且发现它们与酵母的剪接体在结构和机制上存在一些差别。
图6 芽殖酵母剪接体C复合体的冷冻电镜三维结构密度图(图中不同颜色表示不同的蛋白质或RNA组成)
近年来冷冻电镜技术取得了令人难以置信的飞速发展和广泛应用。一方面,随着这项技术的逐渐普及,越来越多的生物学家开始将其作为基本的研究工具,重要程度已不亚于传统的X 射线晶体衍射。而结构生物学领域内的竞争也日趋激烈,越来越多的具有重要生物学功能的生物分子被解析出来。另一方面,样品制备技术的发展,以及硬件和软件上的不断改进使得冷冻电镜技术的适用范围变得越来越广,不再只是局限于大的蛋白质复合体,一些较小的生物分子(< 200 kDa)也可以解析到近原子分辨率水平。
由于冷冻电镜正在变成结构生物学领域的常规技术手段,人们的关注点也逐渐转向X射线晶体衍射力所不及的生物大分子复合体的结构与功能关系,以及动力学分析问题。这就对单颗粒分析的算法提出了更高的要求,三维层面上的分类以及流形分析也就成为了当前研究工作的重中之重。这些问题不断吸引着对生命科学感兴趣的数学家和物理学家参与进来,使得冷冻电镜成为了生物学、物理学、计算科学、统计科学等众多学科的交叉领域。我们有理由相信,这样一个充满活力的研究领域必定会成为打开生命科学大门的一把钥匙,在这个被称作“生命科学的世纪”里大放异彩。
本文选自《物理》2017年第2期
1. 量子力学诠释问题(一)
2. 量子力学诠释问题(二)
3. 高温超导研究面临的挑战
10. 费米子家族新成员——突破传统分类的三重简并费米子的实验发现
END
更多精彩文章,请关注微信号:cpsjournals