分子装上天线能连续24小时“自拍”:新技术有望取代诺奖成果
图片来源:thesprucecrafts.com
撰文 叶巍翔(论文第一作者,德国美因茨大学博士)
编辑 明小
今年的诺贝尔物理学奖颁给了 Arthur Ashkin 教授,他发明的光镊(Optical Tweezer)技术让单分子的动力学过程能得到精确的测量,结合冷冻电镜 (Cryo-EM) 技术还能更准确地分析生物分子的功能。然而光镊并不是完美无暇的,应用时需要对研究的分子施加拉力,难以进行长期测量。
近期,新的研究在长时间观测上有了突破,来自德国美因茨大学(University of Mainz)的叶巍翔博士和导师 Carsten Sönnichsen 教授发明了一项新的纳米尺技术——表面等离子共振纳米尺(plasmon ruler),能超过 24 小时观测单分子的动力学过程,并以视频速率(帧速率 50 Hz,即一秒 50 帧画面)来在线记录。这项研究于 9 月 25 日发表在纳米领域的顶级期刊《纳米快报》(Nano Letters)上。
将两个金纳米天线(gold nanosphere)结合在被研究的单分子上,即组成等离子纳米尺,利用贵金属纳米颗粒的表面等离子共振耦合的散射光谱,来检测纳米尺度的距离变化。叶巍翔博士为研究项目设计并开发了全新的测量仪器——全自动暗场显微镜(dark-field microscope),以白光激光束作为光源,金纳米天线的距离变化能被清晰地观测到,与之相结合的单分子动力学过程从而也能被观测。
实验中所用的单分子是热休克蛋白 Hsp90,由 Thorsten Hugel 教授实验组的 Markus Götz 合成。热休克蛋白 Hsp90 对人体极为重要,协助人体内的许多蛋白进行正常工作,如果它不能正常工作,患上癌症的几率将会增大。
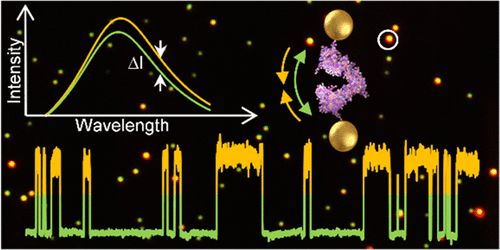
暗场显微镜下观测到的纳米尺真实图像,在黑色背景下犹如星空一般。
如上图所示,每个黄色的点是靠的比较近的两个纳米天线,绿色的点是离的比较远的纳米天线。左上角是纳米天线距离变化时的光谱变化(光谱偏移和光强变化),右上角是热休克蛋白 Hsp90 链接在纳米天线上的示意图。图片下方的方波图是热休克蛋白 Hsp90 结构变化时纳米天线的颜色变化(纳米天线的光强在特定波长的强度变化)。
在暗场显微镜下,这种金纳米天线看起来就像黑夜中的星星一样,它们的散射光的波长不同,显示的颜色也就不同,这取决于它们之间的距离耦合。把单个分子连在两个纳米天线之间,一旦单分子的结构发生变化,纳米天线的距离也会随之变化,从而导致显示颜色的变化。
这一表面等离子共振纳米尺技术的想法,来自十多年前 Carsten Sönnichsen 教授和 Thorsten Hugel 教授在加州大学伯克利分校(University of California, Berkeley)的博士后研究,当时受光镊技术的启发,两位教授产生了新的技术构想,为这一新型纳米尺技术奠定了基础。
与光镊不同的是,这种新的纳米尺在观察单分子的结构变化时不需要施加外力,纳米天线的散射光也不会产生漂光效应(photobleaching,荧光分子无法继续放光的现象),它类似天空中小微粒的瑞利散射。这种纳米尺具有较高的稳定性,可以用来长期观察单分子的结构变化。
这一新技术将已有的其他单分子测量技术的测量范围(如光镊的测量时间和距离)扩展了几个数量级。不仅如此,新的纳米尺技术还能解决全新的问题,例如测试单个分子是否具有记忆性,以及化学结构相同的蛋白质在长时间内的动力学表现是否相同。
基于等离子纳米尺较高的稳定性与长期观察的优点,这项技术有望取代光镊这一诺奖成果,成为下一代分子尺。目前,推广等离子纳米尺技术的最大阻碍就是仪器过于昂贵,为降低仪器成本,叶巍翔博士正在进行新的仪器研究。
论文信息
标题 Conformational Dynamics of a Single Protein Monitored for 24 h at Video Rate
作者 Weixiang Ye, Markus Götz , Sirin Celiksoy, Laura Tüting, Christoph Ratzke, Janak Prasad, Julia Ricken, Seraphine V. Wegner , Rubén Ahijado-Guzmán , Thorsten Hugel, and Carsten Sönnichsen
期刊 Nano Letter
DOI 10.1021/acs.nanolett.8b03342
摘要 We use plasmon rulers to follow the conformational dynamics of a single protein for up to 24 h at a video rate. The plasmon ruler consists of two gold nanospheres connected by a single protein linker. In our experiment, we follow the dynamics of the molecular chaperone heat shock protein 90 (Hsp90), which is known to show “open” and “closed” conformations. Our measurements confirm the previously known conformational dynamics with transition times in the second to minute time scale and reveals new dynamics on the time scale of minutes to hours. Plasmon rulers thus extend the observation bandwidth 3–4 orders of magnitude with respect to single-molecule fluorescence resonance energy transfer and enable the study of molecular dynamics with unprecedented precision.
论文链接 https://pubs.acs.org/doi/10.1021/acs.nanolett.8b03342?ref=highlight
本文来自微信公众号“科研圈”。如需转载,请在“科研圈”后台回复“转载”,或通过公众号菜单与我们取得联系。

科研圈
ID: keyanquan
点击关注,获取最新动态

阅读论文解读及推荐
点击👉关注领研网论文频道。
▽ 精彩回顾 ▽