GATA2
【Blood】骨髓增生异常综合征的遗传易感性:临床特征与克隆进展
骨髓增生异常综合征(MDS)为克隆性造血障碍,以无效造血、血细胞减少、单系或多系发育不良、向急性髓系白血病(AML)发展倾向为特征。儿童和年轻患者的MDS多与胚系遗传易感性相关,Kennedy教授在《血液》(Blood)发表综述,讨论了MDS遗传易感性及其临床评价与治疗以及导致恶性转化的细胞和分子异常及相关假说。
背景介绍
儿童和青少年罹患MDS的高风险特征是患有某些遗传性骨髓衰竭(BMF)综合征。虽然体态特征和家族史可为诊断提供线索,但临床沉默表型很常见,且遗传性MDS易感综合征也可见于老年患者。在基因检测应用之前,MDS遗传易感的诊断只能依靠儿童期完整的综合征特征,成年MDS如无综合征表现则会漏诊。
胚系MDS易感疾病的诊断具有重要意义:区分MDS易感疾病基线发育不良与普通MDS;及时发现疾病早期进展征象,行造血干细胞移植(HSCT);导致其他医疗并发症,HSCT时需行改良预处理方案;避免选择与先证者携带相同胚系突变的供者。
胚系MDS综合征
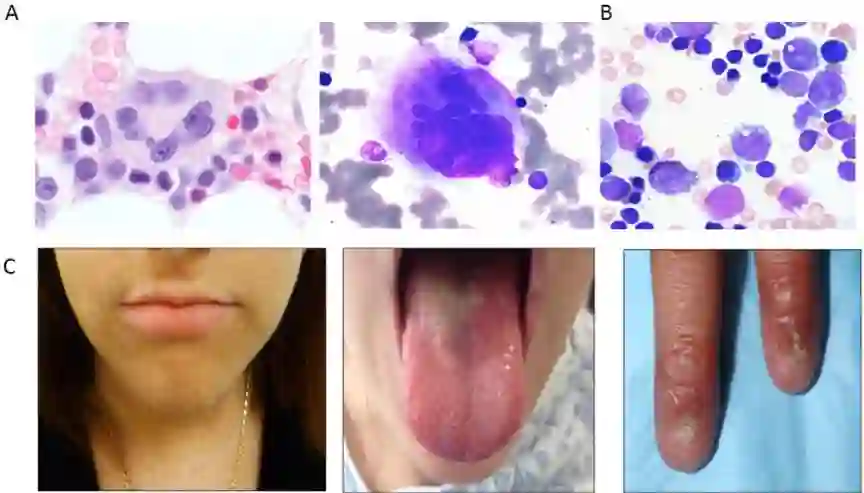
GATA2编码锌指转录因子,对造血、造血干细胞平衡和淋系发育至关重要。胚系GATA2突变表型变化较大,包括MonoMac或Emberger综合征、孤立中性粒细胞减少或BMF不伴综合征特征或家族史。GATA2缺陷典型骨髓表现为增生不良,有特征性的巨核细胞形态异常,如微核(图1),其他表现包括单核细胞减少和免疫异常。携带GATA2突变的MDS常有单体7/del7q(-7)或三体8,尤其是儿童和年轻患者,治疗相关MDS缺少胚系GATA2突变。致病性胚系GATA2突变包括错义、无义、移码、复制、调控区改变、部分或全基因缺失,突变导致单倍体功能不足、DNA结合或转录激活受损。
图1 遗传性MDS易感综合征骨髓组织学和体征改变
SAMD9/SAMD9L
7q22再现性微缺失导致难治性贫血、单体7和AML,该区域包含不育α基序(SAM)结构9(SAMD9)和SAMD9L基因,对细胞增殖有负调控作用。SAMD9L纯合性缺失与正常磷酸盐家族性肿瘤性钙质沉积相关;SAMD9或SAMD9L功能性错义突变杂合子与血细胞减少相关,高危发生单体7/del7q型MDS,临床表型多样;SAMD9和SAMD9L胚系突变见于MIRAGE综合征和共济失调全血细胞减少综合征,表现为高风险年轻发生BMF和单体7 MDS,可不伴综合征特征。
范可尼贫血(FA)
FA特点是基因组不稳定,对DNA交联剂敏感,易患BMF和血液恶性肿瘤及实体瘤。FA的先天性异常变化很大,25%~30%无体征异常,血液学异常包括血细胞减少、大红细胞、骨髓增生不良伴轻度发育异常、BMF伴MDS或AML风险增加,FANCD1/BRCA2亚型白血病发病率更高,多发生于5岁前。FA至少由23个FA基因(FANCA-FANCW)中的任一基因突变所致,这些基因的功能是DNA修复,与染色体断裂性增加相关,HSCT时应降低预处理强度,以免毒性过高。HSCT不能治愈FA,HSCT后并发症和实体瘤风险更高。
Diamond-Blackfan贫血(DBA)
DBA为先天性发育不良性贫血,约一半有躯体异常,典型表现是婴儿期大细胞性贫血和网织红细胞减少,骨髓增生正常,但红细胞再生不良。并发症和死亡的主要原因是治疗副作用和长期恶性肿瘤风险。DBA常见原因是常染色体显性突变导致核糖体蛋白基因单倍体功能不足,约50%为新发突变,RPS19最常见,GATA1的X连锁突变和TSR2的X连锁突变也可导致DBA。成人5q-MDS中,获得性缺失导致RPS14基因单倍体功能不足,与MDS发生和来那度胺治疗敏感相关。
先天性角化不良(DC)/端粒生物学障碍(TBDs)
包括一组与端粒维持功能受损相关的遗传学异质性疾病,临床表型多变 (图1),患者多无明显的综合征特征,血液学并发症包括BMF、MDS和AML。TBDs筛查包括评估淋巴细胞端粒长度,敏感性在成人较低。DC/TBDs有许多非血液并发症,如肺纤维化、肝脏异常和血管异常。患者对化放疗毒隆敏感,需要特殊的移植方案。DC/TBDs至少由13个与端粒维持相关的基因突变引起,因其他疾病也可伴有端粒缩短,故遗传学检测有助于诊断。
Shwachman Diamond综合征(SDS)
SDS的特征是胰腺外分泌功能障碍、BMF及其他体征。MDS可能是首发表现,常见血液学异常是中性粒细胞减少,轻度或重度,暂时性或持续性,其他血液学并发症包括BMF、MDS和AML。骨髓典型表现为低增生伴轻度中性粒细胞生成异常。SDS胰腺外分泌功能障碍检查是最敏感的试验。SDS最常见原因是SBDS基因常染色体隐性突变,包括错义、剪接位点、无义、移码、部分或全部基因缺失。DNAJC21 、EFL1和SRP54的常染色体隐性突变也可表现为SDS。
血小板减少相关的家族性MDS
(1)RUNX1
RUNX1缺陷导致常染色体显性家族性血小板疾病并易患髓系白血病(FPDMM),通常表现为轻中度血小板减少,血小板大小正常,血小板功能缺陷导致过多出血,MDS、AML或淋系恶性肿瘤风险增加。RUNX1编码异二聚体转录因子,对造血、巨核细胞生成和血小板功能非常重要,对某些基因起转录激活或转录抑制作用。RUNX1的胚系突变包括错义、无义、移码、重复、部分或全基因缺失或基因重排。RUNT结构域内的截短突变可能导致亚效突变。
(2)ETV6
ETV6的常染色体显性胚系突变与遗传性血小板减少相关,增加髓系和淋系恶性血液病风险。胚系ETV6突变的特征包括血小板减少、血小板功能异常、大红细胞增生和出血倾向,骨髓低增生伴巨核细胞增生异常、嗜酸粒细胞增多。胚系ETV6突变主要见于ALL,也可见于MDS和AML。ETV6编码与造血、巨核细胞生成和胚系发育相关的转录抑制因子。胚系突变通常位于DNA结合ETS的区域,另有 ETV6连接区的P214L突变报道。
(3)ANKRD26
ANKRD26突变可引起常染色体显性疾病,特征是血小板数量和质量异常以及MDS和AML风险增加。疾病表现为中度血小板减少,血小板大小正常,出血增多,血小板功能和聚集异常。骨髓巨核细胞增生异常,存在低分叶核的小巨核细胞。约5%病例发生急性白血病,2.2%发生MDS,1.3%发生CML,明显高于普通人群。ANKRD26表达变化只存在于巨核细胞,典型突变为点突变。
(4)DDX41
DDX41胚系突变与老年常染色体显性家族性MDS/AML相关,典型表现是正常核型MDS或AML风险增加。DDX41突变相关MDS发生于老年,骨髓低增生,部分病例在髓系恶性肿瘤出现前即有血细胞减少和大红细胞增生表现。DDX41胚系突变通常无非血液学表现,家族史可能是DDX41胚系易感的唯一线索。DDX41胚系突变包括移码、错义、无义和全基因缺失/连续基因突变,与恶性肿瘤相关的体细胞突变多为错义突变。
(5)SRP72
核蛋白复合物基因SRP72的胚系突变与常染色体显性MDS和BMF相关,已发现2个家族携带SRP72杂合子突变,与常染色体显性再生障碍性贫血相关,3~50岁时发生MDS。SRP72基因编码信号识别粒子复合体的一个亚基,突变包括移码和错义突变。
(6)ELANE
严重先天性中性粒细胞减少(SCN)是一组遗传性异质性疾病,特征是中性粒细胞<500/μL。SCN由几个基因突变引起,最常见的是编码中性粒细胞弹性蛋白酶(NE)的ELANE 基因,婴儿早期出现严重中性粒细胞减少和感染并发症。ELANE突变的骨髓表现包括早幼粒细胞成熟停止(图1)。SCN脓毒症死亡的总累积发病率10%,G-CSF治疗15年后发生MDS/AML的总累积率22%。高剂量G-CSF治疗反应不佳时发生MDS/AML风险增加。ELANE基因突变包括错义、无义、移码、剪接、插入和缺失。
Li Fraumeni综合征/TP53
特征是年轻时即高风险罹患多种实体瘤和恶性血液病。TP53胚系突变与Li Fraumeni综合征(LFS)相关,LFS高度外显,MDS倾向于继发于另一原发性肿瘤治疗后,原发性MDS也可见。错义突变是最常见的胚系TP53突变类型(74%),也可发生TP53全部或部分缺失,无义突变和剪接位点突变。
MDS遗传易感性的诊断
年轻患者出现BMF、MDS或AML时,或年龄小的患者肿瘤治疗的血液学毒性较大时,应考虑MDS遗传易感性。临床线索包括躯体异常、内分泌疾病、矮小或不能正常生长、免疫缺陷伴血液学异常。一级或二级亲属具有恶性肿瘤、血细胞减少、先天性异常或化放疗过度毒性的家族史也应注意MDS遗传易感性。胚系突变可能是新发,也可能是亲本嵌合体所致,某些遗传性MDS疾病常有细胞遗传学克隆异常,如GATA2、SAMD9、SAMD9L胚系突变或遗传性BMF综合征常有单体7 MDS,20q缺失或等臂染色体7在SDS很常见,1q+和3q26q29扩增在FA很常见。
疑似胚系遗传性MDS综合征的患者和家庭应接受遗传咨询,可疑患者应检测体组织,如成纤维细胞。为评估MDS体突变设计的检测不应用于评估某一特定基因的胚系突变,因检测内容可能并不相同,检测时还应明确拷贝数的变化。
治疗
胚系MDS易感患者的MDS治愈性手段是HSCT。需注意的是,遗传性BMF综合征会导致预处理方案毒性过大,需减低强度的预处理方案,但这可能降低消除恶性克隆的可能;胚系易感疾病的髓外表现可能增加移植风险;确保干细胞供体不携带相同的疾病;密切监测长期效应,患者常因综合征而表现出独特毒性。
胚系MDS综合征的克隆进展
克隆进展:细胞遗传学
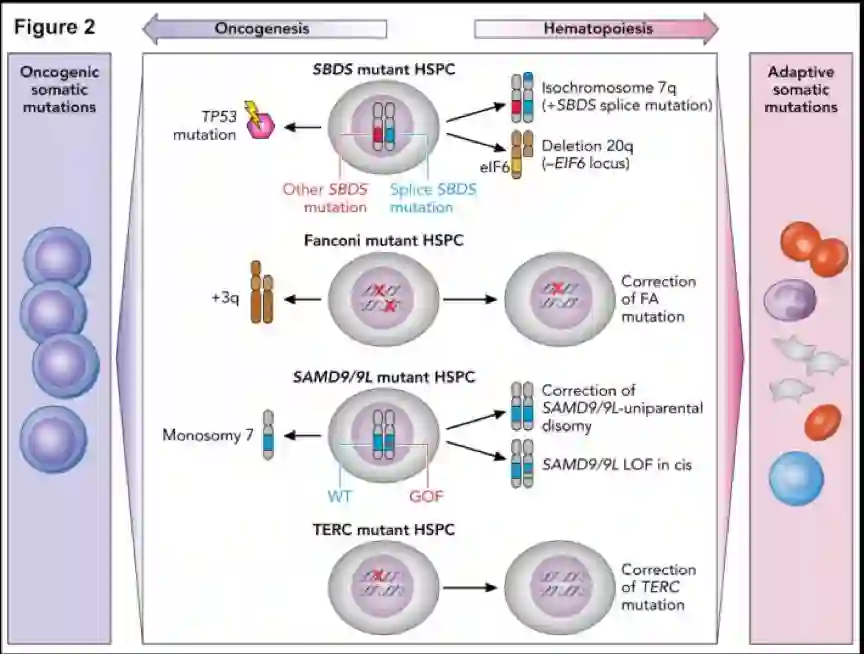
通过胚系MDS综合征可以研究MDS发生前的克隆进化,前瞻性研究体突变事件,了解驱动MDS发生的分子事件,确定具有预后和治疗作用的突变。胚系MDS的克隆可能是适应性也可能是非适应性突变(图2)。适应性突变为内源性造血缺陷提供生存优势,而非适应性突变则促进恶性转化。
SDS有二种适应性克隆改变,等臂染色体7q和del20q,前者与白血病风险增加无关,后者与克隆适应优势相关。适应性体细胞克隆亦见于7号染色体SAMD9/SAMD9L胚系突变,通过失活突变SAMD9/SAMD9L,使血细胞计数改善,适应性体细胞突变包括胚系突变的SAMD9或SAMD9L截短突变或功能丢失性突变,野生型等位基因的遗传学逆转,全部或部分7号染色体缺失,后者促进单体7 MDS的发生。
FA基因的体细胞逆转是通过点突变、基因转换或重组导致部分细胞恢复为野生型FA等位基因而实现,体细胞逆转时可致淋巴细胞染色体断裂检测假阴性。逆转事件似乎并不驱动髓系恶性肿瘤发生,恶性克隆可能来源于突变未纠正的骨髓细胞。另有报道TERC突变的DC,通过有丝分裂重组达到体细胞逆转。
图2 克隆进展的胚系遗传学背景模式图
克隆进展:体细胞基因组学
深度基因组测序可对MDS体细胞突变做更全面的分析。遗传性MDS易感疾病不同的体细胞突变模式表明,胚系遗传背景可能驱动不同的克隆造血机制,体突变可能是适应性变化也可能具有致癌作用。例如,SCN常有G-CSF受体CSF3R获得性突变,CSF3R突变在中性粒细胞减少期和AML期均可检测到,表明单独获此突变并不足以导致AML。SDS的克隆性体细胞突变多累及TP53,此时MDS预后较差,需要功能性研究明确这些突变是否可减少异常的核糖体翻译应激或提供生长优势。
目前缺少胚系MDS综合征体细胞克隆异常的数据,体细胞克隆突变的意义应结合血细胞计数、骨髓形态学和克隆动态变化综合考虑。需要进一步研究体细胞克隆异常的预后意义和潜在的针对癌前克隆的靶向治疗。
Kennedy A, Shimamura A.et al. Genetic predisposition to MDS: clinical features and clonal evolution. Blood 2019: blood-2018-10-844662http://www.bloodjournal.org/content/133/10/1071
分享肿瘤领域最新进展,传播正确肿瘤防治理念。