水通道蛋白门控分子机制研究取得进展
近日,中国科学院武汉物理与数学研究所研究员杨俊团队和华南理工大学教授王菊芳团队合作,在水通道蛋白的门控分子机制方面取得新进展。他们在功能活性状态下对水通道蛋白AqpZ关键“门控”残基的结构、动力学以及水分子接近性进行研究,揭示了水通道蛋白AqpZ的水分子通道处于“永久开放”状态。相关研究结果发表在6月27日的《美国化学会志》(Journal of the American Chemical Society)杂志上(内封面)。
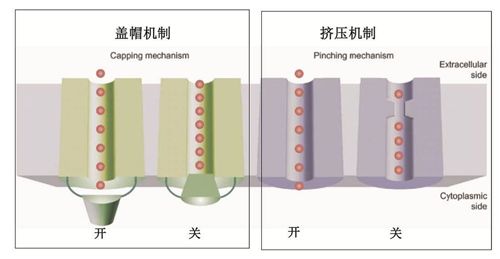
水通道蛋白为细胞膜上特异的水分子通道,与人类健康和疾病密切相关。在以往的研究中,人们根据水通道蛋白晶体结构的水道分析,提出“盖帽”以及“挤压”门控机制。其中AqpZ为典型的“挤压”门控机制代表。在AqpZ同源四聚体的晶体结构模型中,R189侧链存在“朝上”和“朝下”两种不同构象,进一步分子动力学模拟发现R189侧链能够上下快速摆动。R189残基被认为是AqpZ的水道门控开关,它通过侧链上下摆动,改变附近水道直径大小从而控制水道开关。
膜蛋白的结构和功能状态对环境影响敏感,细微的环境变量都可能造成膜蛋白结构和分子机制认识的偏差。在晶体环境中AqpZ的R189侧链的不同构象分布可能来自R189的不同功能状态或者环境因素偏差,因此在天然磷脂膜环境中,AqpZ蛋白的R189侧链门控分子机制值得探究和验证。
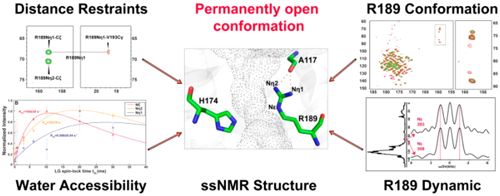
在该项研究工作中,研究人员首先通过化学位移分布以及偶极耦合常数测量证实AqpZ的R189侧链在磷脂膜环境只存在一种稳定的刚性状态,不具有大幅度的运动。然后通过CS-Rosetta手段计算出AqpZ在磷脂膜环境中的三维结构模型,发现R189侧链胍基和A117残基羰基形成稳定的H键,将R189侧链稳定在朝上“打开”状态。最后通过蛋白水分子交换常数测量,验证了R189侧链朝上“打开”分布的合理性。通过AqpZ的结构、动力学以及水分子交换常数分析,证实了AqpZ在功能活性状态下R189侧链朝上稳定分布,处于永久“开放”状态。这项工作提出了水通道蛋白研究中全新的门控分子机制,加深了水通道蛋白的认识,同时也强调了研究环境对膜蛋白分子机制研究的重要性。
这项工作得到了科技部、国家自然科学基金委和中科院的基金资助。新加坡国立大学教授林青松、美国强磁场中心博士傅日强、美国NIH糖尿病消化与肾病研究所博士沈杨、武汉物数所研究员郑安民参与了这项研究工作。
图1 水通道蛋白“盖帽”以及“挤压”门控机制模型
图2 利用固体核磁共振多种提出了水通道蛋白AqpZ的永久开放的门控机制
图3 杂志内封面
来源:中国科学院武汉物理与数学研究所