清华大学医学院胡小玉与药学院陈立功课题组合作在《免疫》发文揭示代谢分子肌酸的免疫调节功能
2019年8月6日,清华大学医学院胡小玉课题组联合药学院陈立功课题组在《细胞》(Cell)子刊《免疫》(Immunity)杂志在线发表了题为 《Slc6a8介导的肌酸转运和积累通过调控细胞因子应答来重编程巨噬细胞的极化》(Slc6a8-mediated creatine uptake and accumulation reprogram macrophage polarization via regulating cytokine responses)的研究论文。该文章揭示了L-精氨酸的下游代谢产物肌酸在干扰素IFN-γ介导的巨噬细胞活化[M(IFN-γ)]和白介素IL-4介导的巨噬细胞活化[M(IL-4)]中分别发挥着关键调控作用。
肌酸在哺乳动物中大多数分布在大脑、骨骼肌和心肌当中,主要通过转运蛋白Slc6a8运输到细胞内。之前的研究表明,肌酸在肌肉和神经系统中以能量介质的形式偶联ADP-ATP的反应并发挥着重要的生理功能,而肌酸在免疫系统中的功能则鲜为人知。在巨噬细胞中,由诱导型一氧化氮合酶(iNOS)和精氨酸酶(arginase 1)介导的两条L-精氨酸代谢通路分别在M(IFN-γ)和M(IL-4)过程中扮演着至关重要的角色,而肌酸代谢作为L-精氨酸的另外一条代谢途径却在巨噬细胞中少有研究。于是,研究人员想要探索肌酸是否也在巨噬细胞的免疫活化过程中发挥重要功能。
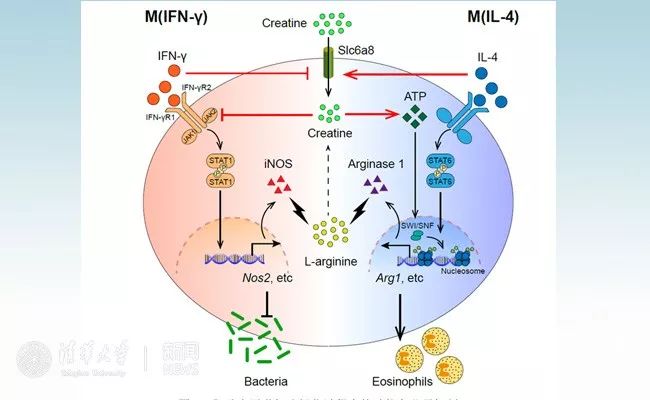
肌酸在巨噬细胞极化过程中的功能和分子机制
在IFN-γ介导的巨噬细胞活化过程中,即M(IFN-γ),IFN-γ抑制Slc6a8介导的肌酸摄取,肌酸通过阻碍IFN-γR2与JAK2相互作用来抑制STAT1磷酸化,从而抑制STAT1靶基因如Nos2的表达,以削弱宿主清除细菌的能力。在IL-4介导的巨噬细胞活化过程中,即M(IL-4),IL-4提升肌酸摄取,肌酸通过ATP提升SWI/SNF活性,维持Arg1启动子染色质开放程度,促进其基因表达,从而增强机体招募嗜酸性粒细胞的能力。从代谢水平来看,肌酸通过抑制iNOS、促进arginase 1的表达来调控巨噬细胞的极化过程,形成一个精密的L-精氨酸免疫代谢调控网络。
在研究思路上,研究人员主要采用功能缺失(Slc6a8基因敲除)和功能获得(补充外源肌酸)的策略来探究肌酸在巨噬细胞中的功能和作用机制。在课题研究初期,和大多数科学探索一样,研究人员对“表型”的探究不算顺利,陷入了寻找肌酸在巨噬细胞中有何功能的困境当中。在长时间地尝试了各种体内和体外实验后,他们发现在生理状态下,巨噬细胞缺少肌酸并不会影响其发育和吞噬功能。此外,在脂多糖(LPS)刺激的条件下,肌酸缺失也不会影响巨噬细胞中LPS介导的下游信号通路和基因表达。这些实验结果一度让研究人员认为肌酸在巨噬细胞中可能没有什么功能,然而研究人员并没有放弃对肌酸功能的探索,直到有一天尝试了干扰素IFN-γ的刺激后,他们惊奇地发现肌酸缺失大大活化了巨噬细胞中IFN-γ介导的下游基因表达,如Nos2和Cxcl9等。并且小鼠体内实验也验证了肌酸在髓系细胞中缺失可以引起iNOS和CXCL9的高表达,从而显著提升小鼠抵抗李斯特菌感染的能力。
这些发现极大地激发了研究人员的探索兴趣,并驱使研究人员想进一步揭示肌酸是通过什么样的机制来抑制IFN-γ介导的基因表达的。因为肌酸是细胞内一种重要的能量介质,研究人员猜想肌酸是否会通过能量相关代谢通路来调控相关基因表达,然而大量实验表明肌酸缺失并不会影响巨噬细胞中AMPK和mTOR等代谢相关信号通路。就在一筹莫展之际,研究人员将目光重新聚集在IFN-γ介导的JAK-STAT1信号通路上。经过大量分子和生化实验分析,研究人员最后发现肌酸是以一种非ATP依赖的方式抑制IFN-γ受体与JAK2的相互作用来阻碍JAK-STAT1信号的传递,从而抑制下游促炎症基因表达。经过以上一番探索,肌酸M(IFN-γ)中藏着的面纱被逐渐揭开,研究人员也没有停止探究的步伐,想继续研究肌酸在M(IL-4)中的功能。利用类似的研究策略和长时间的探索之后,研究人员发现肌酸通过ATP依赖性的染色质重塑来维持一些IL-4关键靶基因的染色质开放程度并促进其表达,增强M(IL-4)的活化,从而使巨噬细胞拥有更强的招募嗜酸性粒细胞和伤口修复的能力。
所以,肌酸与L-精氨酸中iNOS和arginase 1介导的两条代谢通路一样,在巨噬细胞中也发挥着重要功能,这三条代谢通路严密地调控着巨噬细胞的极化,形成一个精密的免疫代谢网络。肌酸在巨噬细胞中作为一类抗炎型代谢物,通过不同的机制来抑制M(IFN-γ)并提升M(IL-4)活化,可以作为一个潜在的靶点用于治疗巨噬细胞极化紊乱带来的疾病,如动脉粥样硬化、肥胖、组织纤维化和肿瘤等,具有重要的生理意义。同时,对肌酸转运蛋白Slc6a8的探索也再次验证了转运蛋白家族在免疫系统中的重要功能,为未来免疫代谢的研究提供了新的思路。
清华大学免疫所胡小玉研究员和药学院陈立功研究员为本文的共同通讯作者,生命科学联合中心2014级直博生吉亮亮和药学院2015级博士生赵心彬为本文的共同第一作者。此外,来自胡小玉课题组的博士研究生张彬、康兰和来自陈立功课题组的博士研究生宋文欣均对本研究作出了重要贡献。该论文还得到了来自清华大学生命科学学院的颉伟研究员和美国特种外科医院的赵宝红博士的大力支持。该研究得到了科技部、国家自然科学基金委、卫健委重大新药创制专项、清华大学-北京大学生命科学联合中学和清华大学免疫学研究所的资助。
论文链接:https://www.cell.com/immunity/fulltext/S1074-7613(19)30277-8

来源:新闻网
供稿:药学院