背景
2018 ESMO | 樊旼教授:分析性验证TMB作为晚期NSCLC一线免疫联合治疗的伴随诊断
2018年10月19日当地时间11点50分,备受瞩目的ESMO大会在德国慕尼黑Messe Munich拉开帷幕。ESMO大会是欧洲肿瘤学领域最具影响力和盛名的年度会议,今年ESMO大会的主题是“Securing access to optimal cancer care”。随着免疫治疗在晚期NSCLC的广泛应用,精准免疫治疗探寻成为当下重要的研究课题。CheckMate 227研究结果显示,TMB>=10mut/Mb(采用FoundationOne CDx平台检测)的患者,接受联合免疫治疗(纳武利尤单抗联合伊匹木单抗)的疗效显著优于化疗。目前,TMB已经从一个探索性预测标志物逐步走向FDA获批的伴随诊断,在本次的ESMO大会上报道的一项研究详实地报道了采用FoundationOne CDx平台检测TMB的分析性验证结果,以支持其获批用于联合免疫方案(纳武利尤单抗+伊匹木单抗)一线治疗晚期NSCLC的伴随诊断。
56PD 分析性验证TMB作为晚期NSCLC免疫联合治疗的伴随诊断
理论上,高TMB的肿瘤可以产生更多的肿瘤新抗原,更容易激活抗肿瘤免疫反应,提高免疫检查点抑制剂治疗的疗效。多个实体瘤的TMB分析显示,黑色素瘤、肺癌、膀胱癌和肠癌等是TMB较高的瘤种。既往小样本量的研究证实,在黑色素瘤和非小细胞肺癌(NSCLC)患者中,高TMB分别与抗CTLA-4单抗和抗PD-1单抗更好的疗效相关。
目前,已经进行了多项研究评估TMB预测晚期NSCLC免疫治疗的疗效:如CheckMate 026研究的探索性分析显示,高TMB(全外显子测序,WES)的患者,接受纳武利尤单抗治疗的PFS显著优于含铂双药化疗。此外,在SCLC患者中,也观察到相似的现象:如CheckMate 032研究中,高TMB(>=248个非同义突变,WES检测)相比于中等和低TMB的患者,接受纳武利尤单抗联合伊匹木单抗治疗的OS显著更长。从这些研究证据可知,采用WES可以评估TMB,且能够预测患者接受免疫治疗的疗效。但目前WES检测TMB仍存在一定的局限性:不同的研究采用不同的检测平台、不同的cut-off值、检测的时间较长、仅一些大型中心可以进行WES检测、成本和对样本质量的要求较高。为克服WES检测TMB的局限性,一些研究探索了采用靶向NGS检测评估TMB,并显示出有前景的研究结果。在CheckMate 026研究中,对比WES和靶向NGS(Foundation One®检测315个基因)检测TMB的一致性,结果显示两者具有非常高的相关性。在NGS靶向测序检测肿瘤组织TMB的基础上,Foundation Medicine还开发出了血浆TMB(bTMB)检测平台(覆盖394个基因的NGS检测),并在POPLAR和OAK研究中回顾性分析了bTMB的预测价值,结果显示,采用bTMB>=16作为cut-off值,可以很好地预测Atezolizumab治疗经治晚期NSCLC的疗效。今年,CheckMate 227研究更是进一步前瞻性证实了TMB的疗效预测价值,在晚期NSCLC一线治疗上,TMB>=10mut/Mb(采用FoundationOne CDx平台检测)的患者,接受纳武利尤单抗联合伊匹木单抗治疗的PFS显著优于化疗。
目前,TMB已经从一个探索性预测标志物逐步走向FDA获批的伴随诊断。FoundationOne CDx(F1CDx)已经获得FDA批准上市,但尚未获批以此平台检测的TMB作为免疫联合治疗伴随诊断的适应症。因此,亟需强有力的证据分析性验证F1CDx的检测效能,以满足最佳的临床实践。本研究详实地报道了采用F1CDx平台检测TMB的分析性验证结果,以支持其获批用于联合免疫治疗(纳武利尤单抗+伊匹木单抗)一线治疗晚期NSCLC的伴随诊断。
方法
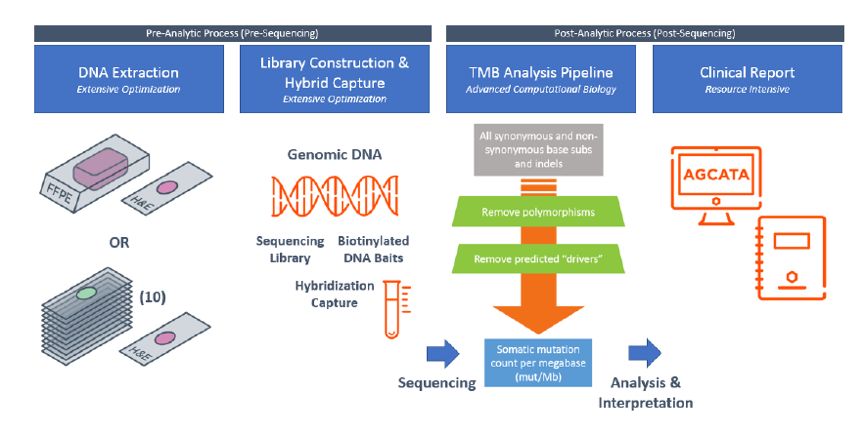
纳入CheckMate 227研究的入组患者,采用F1CDx平台检测TMB。
图1. 采用F1CDx平台检测TMB的流程
结果
1. F1CDx平台检测TMB的准确性
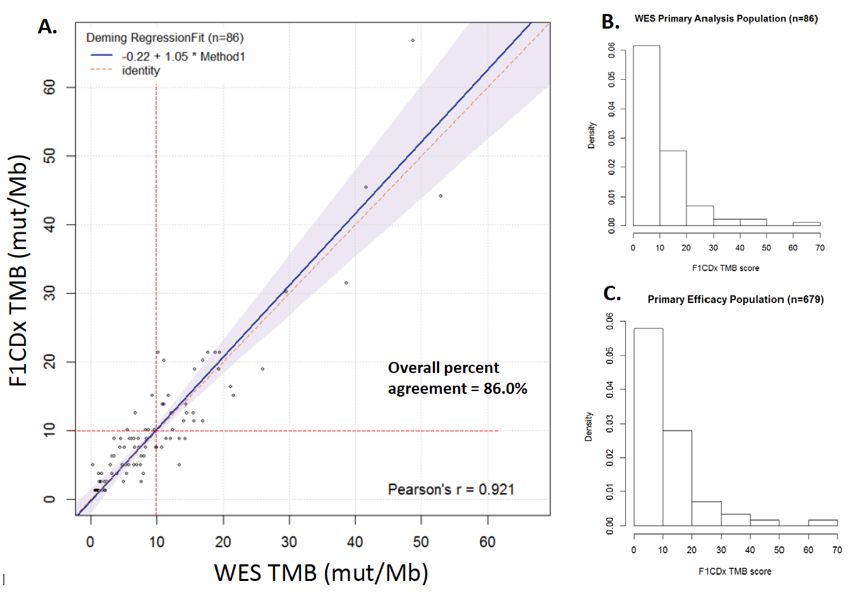
从CheckMate 227研究中随机选择86例患者,分别采用F1CDx平台检测和CLIA认证的WES检测TMB。采用戴明回归模型进行一致性分析,显示两者的一致率为86%(95%CI:76.9%-92.6%),R2=0.92。为了评估这86例患者能否代表总体人群,研究者同时对比了86例纳入准确性分析的人群和CheckMate 227研究中的总体人群的TMB,直方图显示两组人群的TMB分布一致。
图2. F1CDx平台检测TMB的准确性分析
2. 以10mut/Mb为cut-off值,分析F1CDx平台检测TMB的精确性
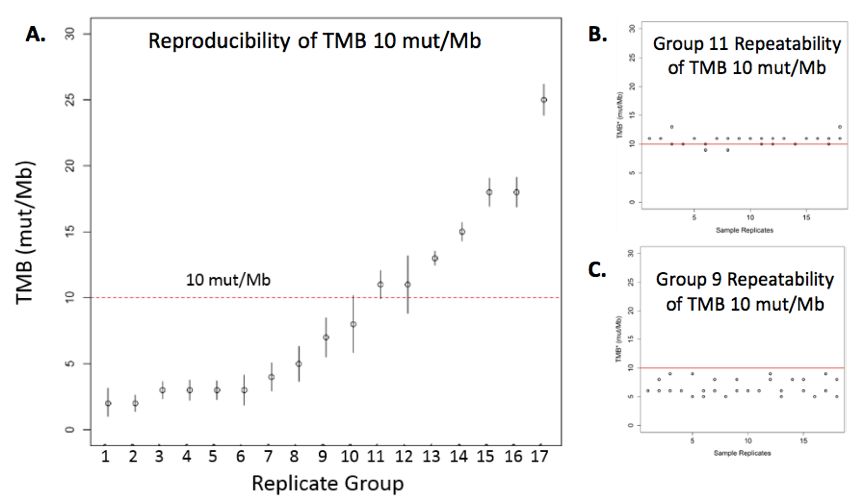
精准性分为可再现性(reproducibility)和可重复性(repeatability)。我们选择17例不同TMB值的NSCLC患者,并对每例患者的样本进行35次或36次重复的检测,来评估检测结果的可再现性。在每一个组内,我们可以评估每个重复检测样本的TMB值和平均TMB值之间的一致性。可重复性评估则关注在每个组内,多次重复检测之间结果的一致性。结果表明,以10mut/Mb作为cut-off值,批次间可重现性 (inter-run reproducibility) 为97.3% (95%CI:95.7%-98.5%) ;批次内可重复性 (intra-runrepeatbility) 为95.3% (95%CI:92.2%-97.4%) 。
图3. 以10mut/Mb为cut-off值,分析F1CDx平台检测TMB的精确性
3. 以10mut/Mb为cut-off值,分析敏感性研究总结
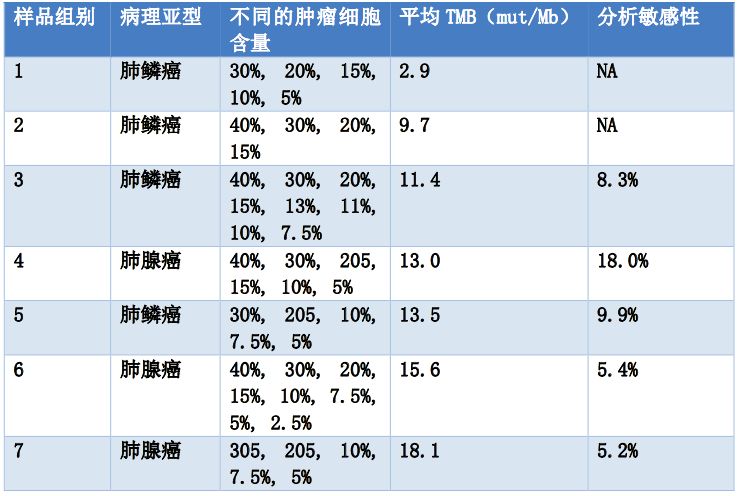
以10mut/Mb为cut-off值进行分析敏感性研究的结果总结见下表。选择7例不同的患者样本进行分析,其平均TMB值与cut-off值距离不同,分别为略低于、略高于、远远低于或远远高于cut-off值。通过加入不同比例正常配对样本DNA的方法,对7例肿瘤患者的DNA样本进行稀释。针对肿瘤细胞含量最高的情况,重复测10次,其他肿瘤细胞含量下,重复测20次。分析敏感性定义为:至少95%的概率可以通过Probit回归检测到TMB>10mut/Mb的状态时所需要的肿瘤细胞含量。结果显示:对于TMB>10mut/Mb的样本,当肿瘤细胞含量为21.9%的时候,可以100%的检测到TMB>10mut/Mb的状态,当肿瘤细胞含量为18%的时候,可以95%的概率检测到TMB>10mut/Mb的状态。
表1. 以10mut/Mb为cut-off值,分析敏感性研究总结
4. 分析性验证确认了F1CDx平台检测TMB的检测效能
这一分析性研究从准确性、精确性、可再现性、可重复性和分析敏感性方面确认了F1CDx平台检测TMB的检测效能,总结见下表。
表2. F1CDx平台检测TMB的检测效能分析总结
总结
这一研究分析性验证了F1CDx以10mut/Mb为cut-off值检测TMB的可重复性和可再现性,以及检测极限(至少95%的概率可以通过Probit回归检测到TMB>10mut/Mb的状态时所需要的肿瘤细胞含量),并通过评估F1CDx和全外显子测序之间的一致性,对其准确性进行了验证,详实证实了其检测效能,研究数据支持其可以作为免疫联合方案(纳武利尤单抗+伊匹木单抗)用于晚期NSCLC一线治疗的伴随诊断。相比于WES,在临床实践中采用靶向测序检测TMB的可行性更高,检测时间短,且cut-off值确定:>=10mut/Mb。
专家点评
主任医师,硕士生导师
复旦大学肿瘤医院放疗中心副主任
复旦大学肿瘤医院肺癌中心副主任
中华医学会上海肿瘤放疗专科分会委员
立体定向放疗学组副组长
上海抗癌协会放射肿瘤学专业委员会委员
上海抗癌协会胸部肿瘤专业委员会委员
中国医师协会放疗营养专业委员会委员
中国抗癌协会放疗专委会肺癌学组委员
教育部新世纪优秀人才
上海市优秀青年医学人才
TMB是目前免疫治疗疗效预测上最具潜力的预测标志物之一,近期多项研究支持了其预测价值。在CheckMate 227研究中,直接以TMB>=10mut/Mb (采用F1CDx) 作为cut-off值筛选入组人群,结果证实在这类患者采用纳武利尤单抗+伊匹木单抗联合方案作为一线治疗,显著优于化疗(1年PFS 43% vs 13%)。本次ESMO大会上,公布的第一项评估bTMB(采用靶向测序平台检测)作为Atezolizumab预测标志物的前瞻性研究B-F1RST结果,也证实了高bTMB患者的ORR显著更高、且在PFS和OS在数值上也观察到更好的趋势。TMB作为NSCLC治疗人群筛选上有潜力的生物标志物,被写入2019年NCCN指南,推荐采用TMB筛选适合接受Nivolumab单药或Nivolumab+Ipilimumab。由此可见,TMB已逐渐从一个探索性预测标志物走向伴随诊断。上述研究入组CheckMate 227研究中的患者,严谨、科学的分析性验证了F1CDx平台检测TMB的检测效能,证实可以采用F1CDx平台精准地检测TMB。相比于WES,F1CDx平台检测更为高效、经济、可行性更高。值得注意的是,研究也存在一定局限性,未来需要在更大样本量的患者中进行更多验证,探索F1CDx平台检测TMB的预测效能。同时,应该探寻TMB如何与其他标准物进行整合,更精准的预测免疫治疗疗效。此外,此研究仅对患者基线状态的TMB进行了评估,后续需要探索动态检测。
Analytic validation of tumor mutational burden as a companion diagnostic for combination immunotherapy in non-small cell lung cancer. 2018 ESMO, 56PD.
41本肿瘤患者指南丛书
点击下方图片即可免费阅读
70个肿瘤相关临床试验招募患者
点击下方图片或识别图片二维码即可查看详情