2019过半了,今年基因编辑领域有哪些重要进展?
点击上方“转化医学网”订阅我们!
干货 | 靠谱 | 实用

CRISPR技术能精确、有效地在活的真核细胞中对基因组进行编辑。该方法以风暴般的速度席卷了整个科学界。2016年,中国科学家首次利用CRISPR基因编辑技术,针对晚期非小细胞肺癌患者开展了人体临床试验,标志着CRISPR-Cas9技术从此开启了人类基因编辑的新纪元,自此相关研究进行地如火如荼。让我们来看看,到目前为止今年关于CRISPR的研究进行地如何。
CRISPR基因编辑成功治愈先天性失明
DOI:https://doi.org/10.1038/s41591-018-0327-9
1月份, Nature Medicine 杂志发表题为Development of a gene-editing approach to restore vision loss in Leber congenital amaurosis type 10 的研究论文。该研究使用Editas Medicine公司(创始人为张锋)开发的编号为EDIT-101的CRISPR/Cas9基因疗法,去除了由CEP290基因中的IVS26突变产生的异常剪接供体,从而使CEP290基因恢复正常表达,成功恢复了Leber先天性黑蒙症10型的视力。这一成果也表明基于CRISPR的基因编辑疗法在治疗遗传疾病方面的可行性。
先天性黑蒙症,是发生最早、最严重的遗传性视网膜病变, 出生时或出生后一年内双眼视锥细胞功能完全丧失,导致婴幼儿先天性盲。Leber先天性黑蒙10型(LCA10)由CEP290基因中的双等位基因功能丧失突变引起。最常见的LCA10突变位点是IVS26,位于内含子26内的腺嘌呤至鸟嘌呤点突变,其突变产生新的剪接供体位点,导致转录提前终止。
由于CEP290基因的编码序列长达7.5kb,远超AAV病毒的包装能力(4.7kb),所以无法通过AAV递送正确编码的CEP290基因的方式来治疗。Editas Medicine开发的特异于CEP290 IVS26突变的基因编辑策略,使用AAV5载体通过视网膜下注射将saCas9和CEP290特异性gRNA递送至感光细胞,通过双gRNA分别靶向突变内含子区域的上下游,直接将突变内含子区域整体删除或倒位,从而恢复CEP290基因的正常表达。这巧妙的避免了AAV病毒包装能力有限的局限,也为这一类遗传病的治疗带来了新的思路。
第三代CRISPR-Cas系统
DOI:https://doi.org/10.1038/s41467-018-08224-4
今年1月份,张锋发表在《Nature communication》上的文章Engineering of CRISPR-Cas12b for human genome提到,他们开发了第三种基因编辑工具CRISPR-Cas12b,该工具经过改造后也能在哺乳动物和人体中进行有效的基因编辑。
之前的研究表明,核酸酶 (AacCas12b)保持体外切割活性的温度范围是40℃至55℃,这不适合于哺乳动物基因组编辑。研究人员用BLAST找出了27个V–B型的Cas12b蛋白,排除了来源于嗜热菌和先前研究过的还剩14个候选者,最终发现四个Cas12b (AkCas12b、BhCas12b、EbCas12b、LsCas12b)可能有活性。体外实验表明,AkCas12b和BhCas12b在37℃仍具有较强的DNA切割活性。
通过一系列实验,研究人员构建了酶活最高的突变体BhCas12b v4(K846R/S893R/E837G),其具有特异性高、安全性好、基因组靶向范围广等优点,有望开发出新一代安全高效的基因编辑工具。
改良基因魔剪助力精准治疗耳聋
DOI:https://doi.org/10.1038/s41591-019-0500-9
前不久,哈佛医学院和波士顿儿童医院的一支联合研究团队,利用优化的CRISPR-Cas9基因编辑系统,在耳聋小鼠模型上精确识别并修正内耳的致聋突变,最终帮助小鼠保留听力,相关研究发表在《Nature Medicine》杂志上。
“贝多芬小鼠”是携带有缺陷Tmc1基因的小鼠。这些小鼠Tmc1基因的DNA序列中有一个错误——腺嘌呤A取代了胸腺嘧啶T,这中错误会导致小鼠听力受损。在人体中,如果Tmc1基因发生突变会导致听力逐渐丧失。
哈佛医学院Blavatnik研究所的科学家改进了传统的CRISPR -Cas9系统,能更好地识别引起耳聋的基因突变。研究人员首先对含有Tmc1基因变异的细胞进行观察发现,修改后的基因编辑系统能够准确区分突变的DNA和Tmc1基因副本中正常的DNA。进一步分析显示,在包含有一个缺陷基因和一个正常基因的细胞中,至少有99% 的CRISPR-Cas9切割只发生在缺陷基因拷贝中。
他们将基因编辑疗法注射到小鼠的内耳中,并进行了DNA分析,结果表明基因编辑活动只发生在贝多芬缺陷小鼠的内耳细胞中。在没有基因变异的小鼠内耳细胞中未检测到基因编辑的迹象,这一发现证实了该工具的准确性。
进一步检测发现,接受基因编辑治疗两个月后,贝多芬小鼠的听力明显好于未接受基因突变治疗的小鼠。而如果不进行治疗,贝多芬小鼠会在在6个月大时就完全失聪。这是继治疗先天性失明后,CRISPR基因魔剪在遗传性疾病治领域的又一突破。
基因编辑技术消灭HIV病毒
DOI:https://doi.org/10.1038/s41467-019-10366-y
近日发表在《Nature Communications》杂志的一项研究显示,美国一个跨多学科的科学家团队,将抑制艾滋病毒的药物和 CRISPR-Cas9 基因编辑技术结合,在 9 只小鼠的基因组中完全消除了艾滋病毒。目前,艾滋病毒的治疗方法抗逆转录病毒疗法(ART)能抑制病毒自我复制,但无法完全消除。而这种新疗法,则首次从活体动物的基因组中消除了 HIV-1 的 DNA。
研究人员使用了两种不同的方法来对抗病毒:CRISPR-Cas9疗法和LASER(long-acting slow-effecting release)ART疗法。LASER ART是ART疗法的进阶版,能够使病毒在较低水平上长时间复制,然后将抗逆转录病毒药物储存在纳米晶体中,在病毒所在位置缓慢释放药物。
分别用LASER ART疗法、CRISPR-Cas9疗法以及两者结合这三种疗法治疗感染HIV的小鼠八周后,研究者发现超过30%接受了ART疗法和CRISPR-Cas9疗法的小鼠体内任何组织中都没有检测到HIV。而单独接受两种疗法的小鼠体内仍然可以检测到HIV。
研究人员称,如果按顺序进行抑制HIV复制的治疗和基因编辑治疗,就可以从受感染动物的细胞和器官中清除HIV。
Cas9切割DNA的高清三维图像首次被捕获
DOI:https://doi.org/10.1038/s41594-019-0258-2
近日,来自不列颠哥伦比亚大学(UBC)研究团队,使用低温电子显微镜(cryo-EM)首次在精确切割DNA链的过程中捕获了酶的高分辨率三维图像。这显示了有关基因编辑工具CRISPR-Cas9如何工作的信息,将有助于研究人员开发出更高效、更精确地操作以改变目标基因的工具。
研究者将Cas9复合物快速冷冻并使用cryo-EM成像,最终捕捉了Cas9在与核酸结合过程中的三种不同的结构排列的快照。其中两种中,目标DNA被切割后但酶仍然没有解离。状态II和III显示在Cas9催化后立即发生的重排并随之转化为与后续产物结合的中间体。
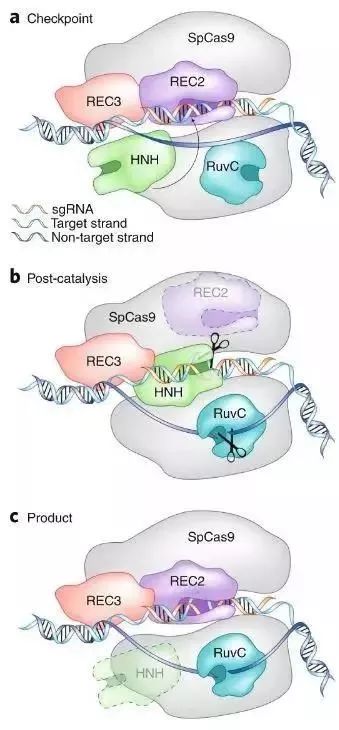
该研究提出了Cas 9-sgRNA和DNA复合物以及Mg2+存在时的结构。在溶液中捕获了三种不同的状态,提供了Cas9切割其DNA靶标的机制。并且基于这些结构发现,提出了Cas9催化的RNA指导的DNA切割的修订模型,为以后开发更高效和精准的基因编辑工具提供了理论支持。
新型RNA单碱基编辑器
DOI:10.1126 / science.aax7063
近日,张锋团队在 Science 杂志发表了题为A cytosine deaminase for programmable single-base RNA editing的文章,他们开发了名为RESCUE的RNA单碱基编辑器,可以通过靶向特定的RNA杀死致病蛋白。
RESCUE编辑器可以靶向任何特定RNA,通过改进的ADAR2组件执行C-to-U的单碱基编辑。研究人员将其引入人体细胞,发现它们可以靶向细胞中的天然RNA,以及合成RNA中的24个临床相关突变。
实验中,研究团队利用RESCUE系统对编码APOE4的RNA进行编辑。之前的研究表明,APOE4是导致阿尔茨海默症的风险因子。研究发现,APOE2蛋白与之相似但是相对无害,两者之间只有两个差异(APOE4中的C与APOE2中的U)。研究人员通过RESCUE系统,他们成功地将APOE4 RNA分子中的两个字母从C变成了U,从而将风险因子转变成了无害蛋白。
RESCUE极大地扩展了基因编辑工具可以应用的领域,包括蛋白质中的可修饰位置,像是磷酸化位点。这些位点在蛋白质活动中起着开关的作用,在信号分子和癌症相关通路中尤为明显。为了促进将RESCUE推向临床应用,张锋团队计划免费分享RESCUE系统,让全世界更多研究人员能够使用它来更好地了解引起疾病的基因突变。
致敬科学家们!
点击阅读原文了解:第二届上海国际癌症大会