癌细胞抗癌?CRISPR助攻抗癌新疗法!|Science子刊
点击上方“转化医学网”订阅我们!
干货 | 靠谱 | 实用
导 读
经过生物工程改造以表达治疗靶向位点的肿瘤细胞已成为未来抗肿瘤治疗的希望之星。然而,尚未有研究结果阐明这些改造的肿瘤细胞特异性靶向的细胞表面受体及经其治疗后的疗效。研究人员设计并合成了能够对原发性和复发性肿瘤具有特异性配体的治疗性肿瘤细胞,并在抗性癌细胞和敏感性癌细胞两种细胞中开发了两种治疗技术。该研究展示了工程化癌细胞的治疗潜力,并对该技术在初发、复发和转移性肿瘤中进行临床应用有很强的指导意义。
转移性肿瘤新克星-自靶向肿瘤细胞
近年来,随着分子生物学、医学影像技术、药物研发及手术技术的不断发展,许多先前被认为是“不可治愈”的肿瘤类型已经被不断攻破。然而,许多特发性和系统性的肿瘤类型,尤其是一些转移性肿瘤,仍然面临无药可用、无手段干预的情况。
最近几年,一些研究试图利用肿瘤细胞的自归巢(Self-homing)特性将抗肿瘤制剂依靠归巢的肿瘤细胞自靶向至原发性肿瘤。而目前最有希望的方法包括使用肿瘤细胞递送溶瘤病毒、使用表达自杀基因的工程化肿瘤细胞将死亡信号转移到邻近的肿瘤细胞,以及通过能够影响血管生成的工程化癌细胞改变肿瘤微环境。
然而应用这种自靶向肿瘤细胞同样是把双刃剑—由于转基因的自毒性导致这些自靶向肿瘤细胞过早的消耗进而影响治疗效果;由于自靶向细胞的长期存活导致继发性肿瘤的产生。为此,研究人员对这些重新复位的自靶向肿瘤细胞进行了深入的研究并利用CRISPR-Cas9基因编辑技术对其进行改造增强这些细胞的最终抗肿瘤特性。
杀伤与被杀伤,反复消灭肿瘤细胞
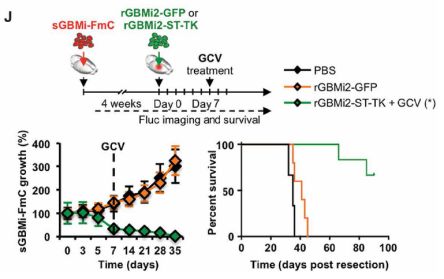
研究人员首先筛出细胞死亡受体(death receptor,DR)敏感的胶质母细胞瘤(sGBM)和3种抗细胞死亡受体的胶质母细胞瘤(rGBM),通过RT-PCR反转录发现所有的sGBM均能够表达死亡受体,进而在受体与配体结合后启动细胞凋亡途径。
另外3种rGBM均不表达该受体,因此它们也不会因DR配体的存在而凋亡。研究人员利用慢病毒使rGBM能够持续表达DR的配体,并且证明经过基因改造的rGBM在不受DR信号的影响下能够大量消灭sGBM。
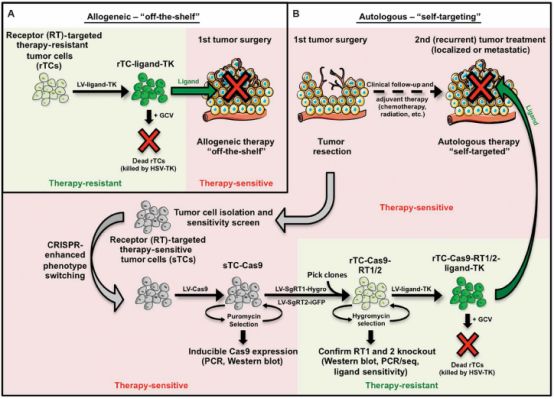
敏感型的胶质母细胞瘤(sGBM)被消灭了,那如何保证导入的抗性母细胞瘤(rGBM)不产生继发性肿瘤呢?研究人员将更替洛韦(GCV)转化酶利用基因编辑技术导入rGBM当中,是这些细胞对更替罗韦更加敏感。就此,研究人员便可以利用改造后的rGBM杀灭sGBM,同时利用更替洛韦杀灭rGBM。
CRISPR基因编辑:将胶质母细胞瘤研究成果推向各类肿瘤治疗
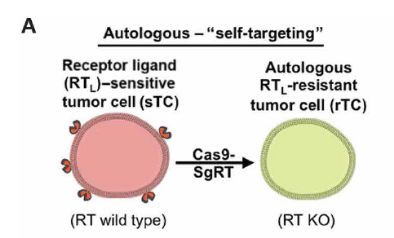
研究人员首先利用CRISPR基因编辑技术敲出了sGBM中的DR4和DR5基因,制备成了DR-knockout(KO)-GBM,同时也验证了利用该基因编辑技术可以对其他肿瘤细胞进行相同的处理。
介此,对于同种异型的肿瘤,可利用异体受体非敏感型肿瘤细胞杀灭患者体内受体敏感型肿瘤细胞,再使用更替洛维消灭导入的受体非敏感型肿瘤细胞。对于自体肿瘤,可将患者手术中所获肿瘤细胞利用CRISPR基因编辑技术敲除受体基因并导入GBV转化酶基因,经改造后的肿瘤细胞可用于消灭转移性和复发性肿瘤。
该研究的意义在于揭示了工程化受体靶向肿瘤细胞在治疗原发性,复发性和转移性肿瘤中的可行性和安全性。 同时,也为工程化肿瘤细胞进入临床实验打下了坚实的实验理论基础。
参考文献:
Clemens Reinshagen, Deepak Bhere, Sung Hugh Choi, Stefan Hutten,Irina Nesterenko. CRISPR-enhanced engineering of therapy-sensitive cancer cells for self-targeting of primary and metastatic tumors
END
为推动癌症研究技术、方法创新,促进基础研究向临床和产业转化,2018首届国际癌症大会暨第三届国际癌症代谢与治疗大会暨第四届全国肿瘤代谢年会将于2018年10月12-14日在上海召开。识别二维码,了解更多大会信息。
今日内容,精彩继续
1、癌细胞抗癌?CRISPR助攻抗癌新疗法!|Science子刊
2、《转》访上海市精神卫生中心院长徐一峰:玩转VR、融入药物基因组学,精神专科焕发新活力
3、相约十月魔都:2018年中华临床跨组学精准医学人才培训班·肿瘤精品班即将开班
4、高血压与肠道微生物:你是我的小确幸
推荐阅读:
3、嘉宾风采 | M.D.Anderson肿瘤中心Zhimin(James)Lu教授应邀参加 ICC &CMT并做主题演讲