一文看懂 | 君实生物执行董事姚盛博士深度解读特瑞普利单抗的探索之旅!
2013年,癌症免疫治疗因为其卓越的疗效和创新性,被《科学》(Nature)期刊评为年度最重要的科学突破。近年来,癌症免疫治疗捷报频传,也让免疫检查点抑制剂成为肿瘤治疗领域炙手可热的“网红”,尤其在2018年,免疫风暴正式席卷中国。截至目前,已经有4款PD-1单抗在国内获批上市,开启了中国肿瘤免疫治疗2.0时代!2018年12月,君实生物的特瑞普利单抗 (Toripalimab, 拓益TM)在中国获批用于标准治疗失败的晚期黑色素瘤,改变了中国没有国产免疫检查点抑制剂的历史。与此同时,其亲民的价格也让更多肿瘤患者看到了新的希望。那么特瑞普利单抗是如何一步步地从实验室走向临床,成为国内首个国产PD-1单抗的呢?
上海君实生物医药科技股份有限公司执行董事/副总经理
TopAlliance 高级副总裁
苏州君奥董事
参与本集团有关JS002及JS003的若干注册专利及申请中专利发明
曾任梅奥医学院的免疫学研究人员
约翰霍普金斯大学医学院肿瘤科研究员
耶鲁大学癌症中心助理科学家
免疫治疗是如何从实验室一步步走向临床的?
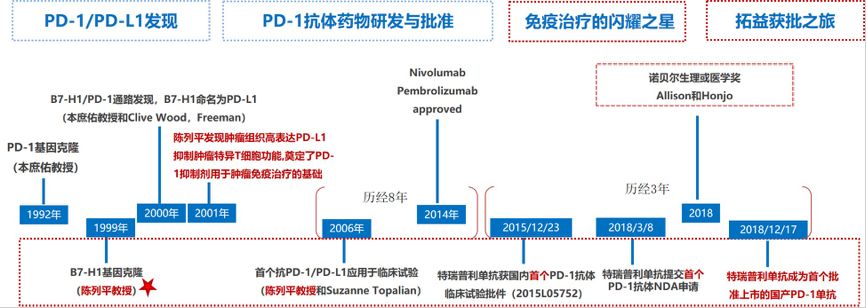
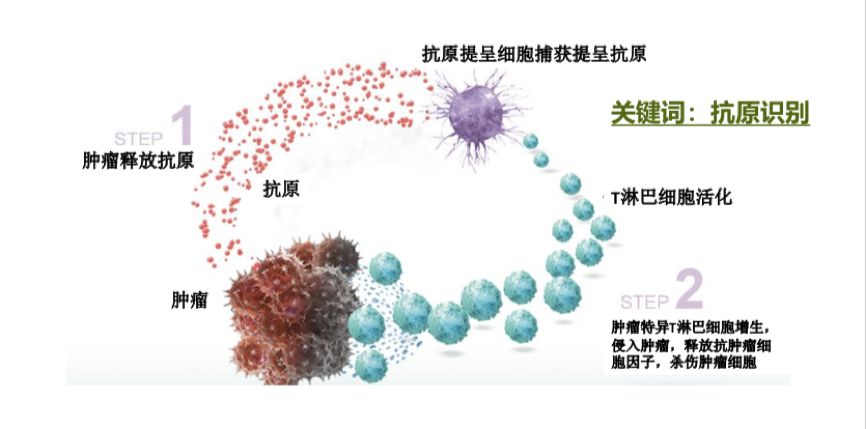
姚盛博士:1992年,日本科学家本庶佑教授完成PD-1的基因克隆。1999年,著名华裔科学家陈列平教授成功克隆PD-L1基因,并于2001年发现PD-L1免疫抑制功能。2006年,PD-1/ PD-L1开始应用于临床试验,并历经8年,在美国成功上市,开启肿瘤免疫治疗新时代(图1)。从机制上,肿瘤利用PD-1/ PD-L1通路产生免疫逃逸,当肿瘤细胞遇见对肿瘤有直接杀伤作用的肿瘤浸润特异性T淋巴细胞时,迅速上调PD-L1的表达,结合活化T淋巴细胞表面的PD-1,抑制淋巴细胞功能(图2)。
图1 免疫治疗发展简史
图2 抗肿瘤的机体免疫机制
特瑞普利单抗作为第一个获批上市的国产原研免疫检查点抑制剂,其在结构和机制上有哪些特点和优势?
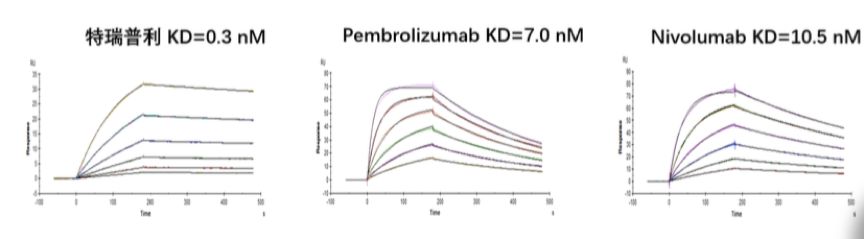
姚盛博士:特瑞普利单抗是一款国产原研免疫检查点抑制剂,属于IgG4/Kappa亚型,具有完全自主知识产权。特瑞普利单抗具有全新的CDR序列,不同于帕博利珠单抗主要结合PD-1抗原C’端的D环和纳武利尤单抗主要结合N端环,特瑞普利单抗主要结合PD-1抗原的FG环,导致受体的构象变化。在体外结合力头对头试验中,与帕博利珠单抗和纳武利尤单抗相比,特瑞普利单抗与PD-1的结合力更强,且结合PD-1后比帕博利珠单抗和纳武利尤单抗更缓慢解离(图3)。
图3 特瑞普利高亲和力结合PD-1并延迟解离
抗肿瘤机制研究显示,特瑞普利单抗具有独特的强劲诱导PD-1内吞的作用,使得特瑞普利单抗不仅能阻断PD-1和配体结合,并能同时降低PD-1膜表面表达。甚至在没有配体PD-L1存在的情况下,高表达PD-1受体的T淋巴细胞处于功能抑制状态,减少细胞表面PD-1受体表达,可以减少近膜区去磷酸酶浓度,从而增强T细胞自身活化功能。
综合来看,特瑞普利单抗具有高亲和力结合PD-1,强效阻断PD-1通路,提高了抗肿瘤疗效;通过介导内吞效应,降低PD-1膜表面表达;显著提高体内外T细胞增殖能力及抗肿瘤效应。相关研究成果已经在mAbs 期刊在线发表。
自2015年获得首个临床试验批件至今,特瑞普利单抗相关研究硕果累累,可否请您分享一下特瑞普利单抗的重点临床研究有哪些?
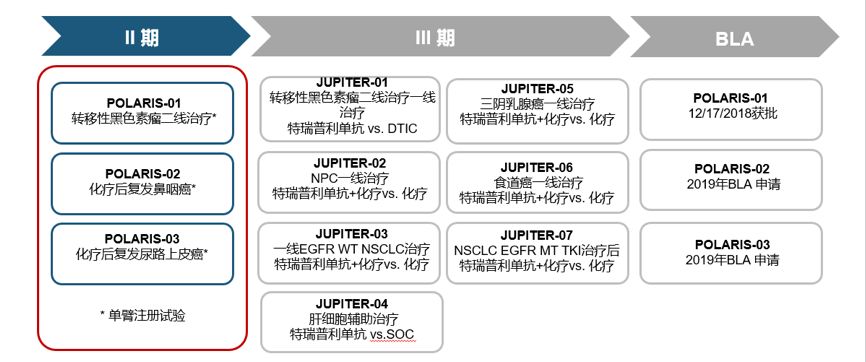
姚盛博士:截至2019年3月31日,特瑞普利单抗在14种适应证中开展了25项临床试验,包含众多晚期瘤种,累计治疗超过1500例癌症患者,在多项实体瘤的临床研究中显示出安全性和有效性。POLARIS-01(CT-4)、POLARIS-02、POLARIS-03等众多研究结果显示,特瑞普利单抗对多个瘤种显示出良好的有效率,初步结果不劣于已上市的同类产品。目前我们在黑色素瘤、鼻咽癌、尿路上皮癌、霍奇金淋巴瘤、非霍奇金淋巴瘤、胃癌、食管癌、软组织肉瘤等临床研究中均出现完全应答患者。
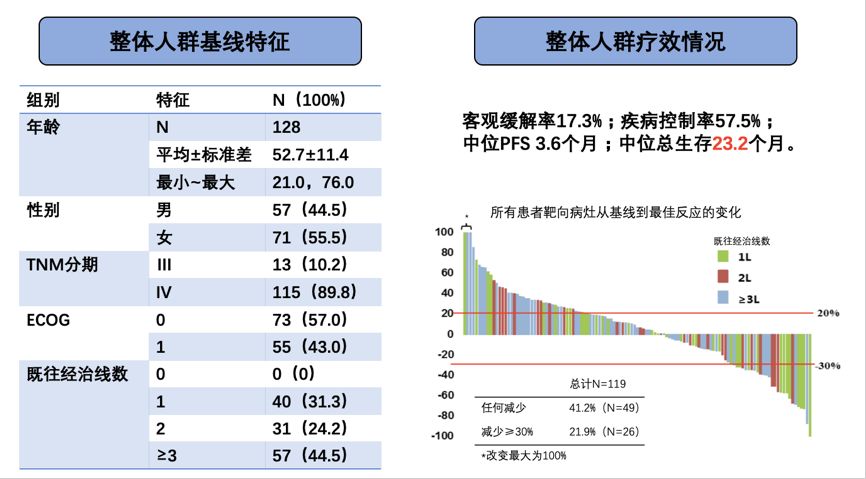
POLARIS-01研究入组二线及二线以上晚期转移性黑色素瘤患者。由北京大学肿瘤医院郭军教授主持,在国内多个黑色素瘤中心共计入组128例患者,其中一线治疗失败的患者是31.3%,二线及二线以上的患者占比68.7%。目前最新的研究数据显示,整体人群中ORR为17.3%,DCR为57.5%,中位PFS为3.6个月,而中位OS为23.2个月(图4)。
图4 POLARIS-01研究特瑞普利单抗治疗2线及
以上晚期转移性黑色素瘤
在非头对头试验对比中,将POLARIS-01研究与同在中国人群中进行的研究KEYNOTE-151研究进行对比,POLARIS-01研究入组患者多为接受过二线或三线,而KEYNOTE-151研究则100%为一线治疗失败的患者。结果显示两种PD-1单抗的ORR基本相当,特瑞普利单抗的中位OS为23.2个月,而帕博利珠单抗的中位OS为12.1个月。
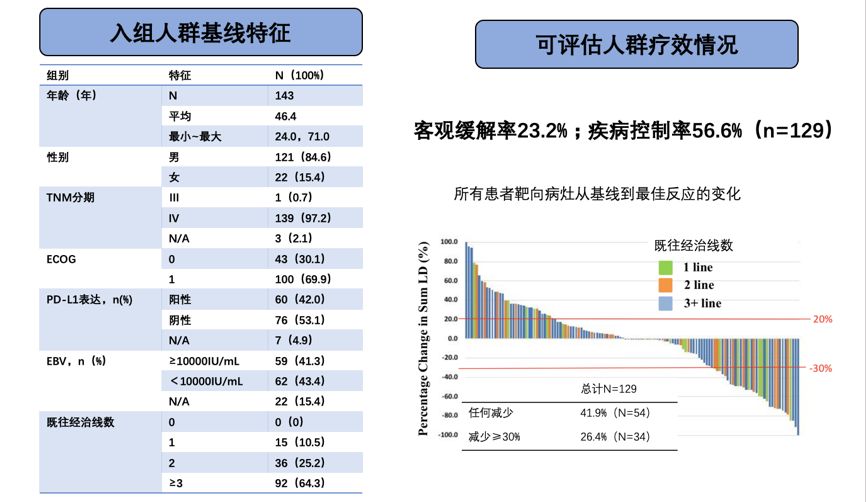
除了黑色素瘤,特瑞普利单抗针对其他瘤种的研究也正在进行。POLARIS-02研究是特瑞普利单抗治疗二线及以上晚期转移性鼻咽癌患者的研究,去年ESMO会议报道截至2018年9月共计入组143例患者,在可评估人群中进行疗效评估,结果ORR为23.2%,DCR为56.6%(图5)。POLARIS-03研究是针对特瑞普利单抗单药末线治疗晚期尿路上皮癌患者的研究,最终结果会在今年ASCO公示。研究的结果会进一步对Ⅲ期研究产生影响,未来的Ⅲ期研究将会设置更多的分层分析、亚组分析、筛选分析。
图5 特瑞普利单抗治疗2线及以上晚期转移性鼻咽癌
黏膜型黑色素瘤易转移、生存差,对标准治疗、化疗、靶向治疗、免疫单药治疗不敏感,如何破解?
姚盛博士:临床试验的一项重要问题是找到免疫治疗的适用人群,而目前免疫治疗存在的一个问题是70%的患者不能从免疫单药治疗中获益,临床研究也需要探索,如何使得这部分患者获益。君实生物会对大量Ⅱ~Ⅲ期临床试验进行分析,进一步设计联合治疗的方向。
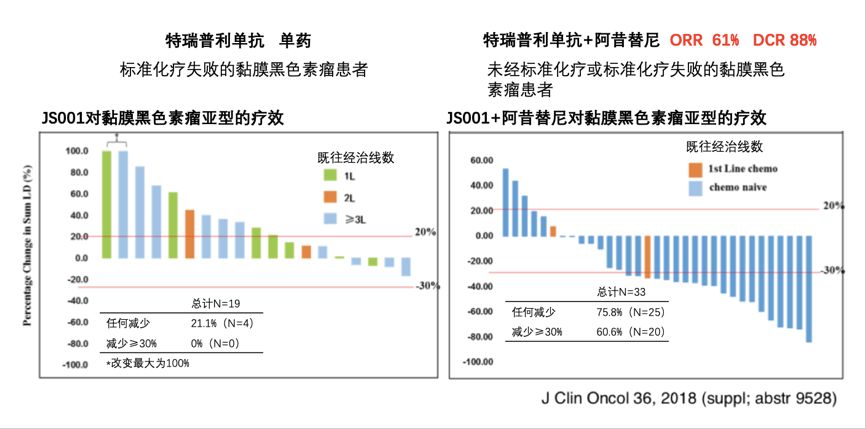
考虑到黏膜型黑色素瘤的突变率低、血管丰富等特点,在郭军院长的领导下,研究者提出了新的联合治疗方案。针对黏膜型黑色素瘤的治疗挑战,基于免疫治疗与靶向治疗的协同作用,设计了特瑞普利单抗与阿昔替尼(Axitinib)联合的临床研究,机制是肿瘤微环境的血管组织和淋巴细胞浸润正常化与肿瘤环境的免疫细胞功能的正常。结果显示特瑞普利单抗联合阿昔替尼治疗转移性黏膜型黑色素瘤的ORR达到61%,DCR达到88%(图6)。
图6 特瑞普利单抗与阿昔替尼联用
特瑞普利单抗已经在众多瘤种中开展相关临床试验,研发团队是基于什么样的考虑,最终选择这些瘤种进行临床试验的呢?
姚盛博士:机体识别肿瘤抗原从而杀伤肿瘤是免疫治疗起效的根本机制。肿瘤抗原的主要类型有:①病毒抗原,因为病毒抗原属于外源抗原,容易被机体T细胞识别。因此,由病毒抗原引起的肿瘤,免疫治疗效果相对更好。②肿瘤特异抗原,肿瘤特异抗原主要是由于突变引起的。③肿瘤相关抗原,如肿瘤高表达的抗原。典型的应用如乳腺癌HER2的表达。
特瑞普利单抗对注册临床适应证的选择有以下两大原则。第一项原则就是需要选择对免疫治疗敏感的瘤种,例如三项Ⅱ期单臂临床试验。以黑色素瘤为例,尤其在西方世界,黑色素瘤是一种肿瘤突变负荷较高的瘤种,免疫源性较强。鼻咽癌大多由EB病毒感染引起,因此可以选择鼻咽癌进行免疫治疗的尝试。第二项原则就是重视中国特有肿瘤的治疗,这类肿瘤在西方世界易被忽视。在特瑞普利单抗的临床试验中,特瑞普利单抗联合化疗用于一线治疗中国高发的晚期食管癌和鼻咽癌以及辅助治疗胃癌和肝癌。对于中国EGFR阳性突变高的非小细胞肺癌也进行了针对性的研究(图7)。
图7 特瑞普利单抗临床适应证的选择及
部分正在进行的临床试验
在精准治疗时代,我们应该如何精准选择合适的患者进行免疫治疗?
姚盛博士:对于注册临床试验进行分析,就需要对获益人群进行分析。而肿瘤特异T细胞是分子标志物的核心。目前临床较常用的分子生物标志物包括MSI-H、dMMR、PD-L1等均为预测存在肿瘤特异T细胞的间接证据。在今年ASCO会议上,君实生物将会报道更多原创的生物标志物与疗效的关系。
特瑞普利单抗在给药剂量方面开展了哪些探索?
姚盛博士:剂量选择是严谨的临床求证过程,在临床试验中,君实生物进行了非常详尽的剂量对比,最后根据最低的药物血液谷浓度、安全性和有效性结果才决定目前在大部分Ⅲ期临床试验中应用240mg每3周1次的剂量。
特瑞普利单抗的PD-1受体占位和功能饱和浓度为1.5~2.5μg /ml,剂量选择的目标是稳态谷浓度维持在10倍的饱和浓度15~25μg/ml以上。在特瑞普利单抗的剂量PK研究中,3mg/kg单剂量平均谷浓度为13~18μg/ml,每2周1次的稳态谷浓度平均超过30μg/ml,因此3mg/kg,每2周1次被推荐于Ⅱ期研究。240mg单剂量平均谷浓度为12μg/ml,每3周1次的稳态谷浓度平均24μg/ml,因此240mg,每3周1次被推荐为用于Ⅲ期研究。在多项剂量探索研究中显示,从1mg/kg到10mg/kg,每2周1次,特瑞普利单抗没有显著地暴露量和疗效的关系。
总结
特瑞普利单抗的获批,填补了国产PD-1单抗的空白。这让中国患者有机会以可承受的价格接受国际前沿的肿瘤免疫治疗。作为国产原研创新药,特瑞普利单抗有其特色,而疗效可靠,安全性良好。其与靶点的亲和力和结合稳定性均达到国际先进水平。特瑞普利单抗最先获批的适应证是黑色素瘤。而鼻咽癌、尿路上皮癌、非小细胞肺癌、胃癌、食管癌、肝癌等相关临床试验正在进行中,随着临床试验的推进,未来也将陆续申请上市。未来,期待特瑞普利单抗能够为更多肿瘤患者带来生存福利。
41本肿瘤患者指南丛书
点击下方图片即可免费阅读
70个肿瘤相关临床试验招募患者
点击下方图片或识别图片二维码即可查看详情