ALK阳性的NSCLC通过上调PD-L1表达介导免疫逃逸
“ALK学院”借助线上资源,搭建学术交流平台,旨在汇聚肺癌ALK靶向学术内容,提高医生对ALK靶向治疗规范性的认识,精进诊疗水平。平台推出资讯追击、ALK文章荟萃两大板块,更多资讯请识别图中二维码关注专栏!本期“ALK学院”精选6篇中国专家文献,每日一文以飨读者!
目前,免疫治疗是抗肿瘤研究的热点。EML4-ALK重排是NSCLC重要的驱动基因之一,研究发现,NSCLC患者PD-L1高表达与EGFR突变和EML4-ALK重排相关。那么,PD-L1蛋白表达是否受ALK-TKI影响,抗PD-1/PD-L1单抗治疗ALK阳性NSCLC患者是否有效,目前尚未明确。来自中山大学附属肿瘤医院张力教授团队的研究在ALK阳性的NSCLC细胞株中探索了EML4-ALK融合蛋白对PD-L1蛋白表达的调节,以及抗PD-1/L1单抗治疗ALK阳性NSCLC的疗效,该研究于2015年发表在OncoImmunology杂志上。
主任医师、博士生导师、肺癌内科首席专家
中山大学附属肿瘤医院内科主任
中山大学肺癌研究中心副主任
中山大学附属肿瘤医院国家新药(抗肿瘤药物)临床研究(GCP)中心主任、Ⅰ期病房主任
国家药品食品监督管理局(SFDA)药物评审咨询专家
澳门镜湖医院放射治疗中心顾问医生
背景
EML4-ALK重排是NSCLC重要的驱动基因之一,约占NSCLC患者的4-8.1%。目前,对于EGFR突变和ALK重排的患者,一线靶向治疗已成为标准治疗。然而,大多数的患者最终会出现耐药,对于TKI耐药后的患者,目前缺乏有效的治疗手段,亟需新的有效的治疗方案。
目前,免疫治疗是抗肿瘤治疗的热点,已经获批了多个免疫治疗药物。对比化疗,抗PD-1和PD-L1单抗在小部分NSCLC患者中取得了持久的疗效。免疫治疗价格昂贵,探索有效的生物标志物,以筛选最有可能从免疫治疗中获益的患者非常重要。目前,一些研究提示,PD-L1表达可能可以预测抗PD-1/L1单抗治疗的疗效。因此,有必要探寻PD-L表达的基因背景以及其如何影响治疗疗效。
近期一项研究提示,NSCLC患者PD-L1高表达与EGFR突变和EML4-ALK重排相关。另一项研究显示,EGFR突变的治疗表现为PD-L1高表达,且EGFR突变的鼠动物模型对抗PD-1单抗治疗有响应,这就提示EGFR突变可能是预测PD-1单抗疗效的标志物。然而,PD-L1蛋白表达是否受ALK-TKI影响,以及抗PD-1/PD-L1单抗治疗ALK阳性NSCLC患者的疗效,目前尚未明确。本研究旨在探索EML4-ALK融合蛋白对PD-L1蛋白表达的调节,并评估抗PD-1/L1单抗治疗能否作为EML4-ALK阳性对ALK-TKI敏感或耐药的NSCLC患者有效的治疗选择。
方法和结果
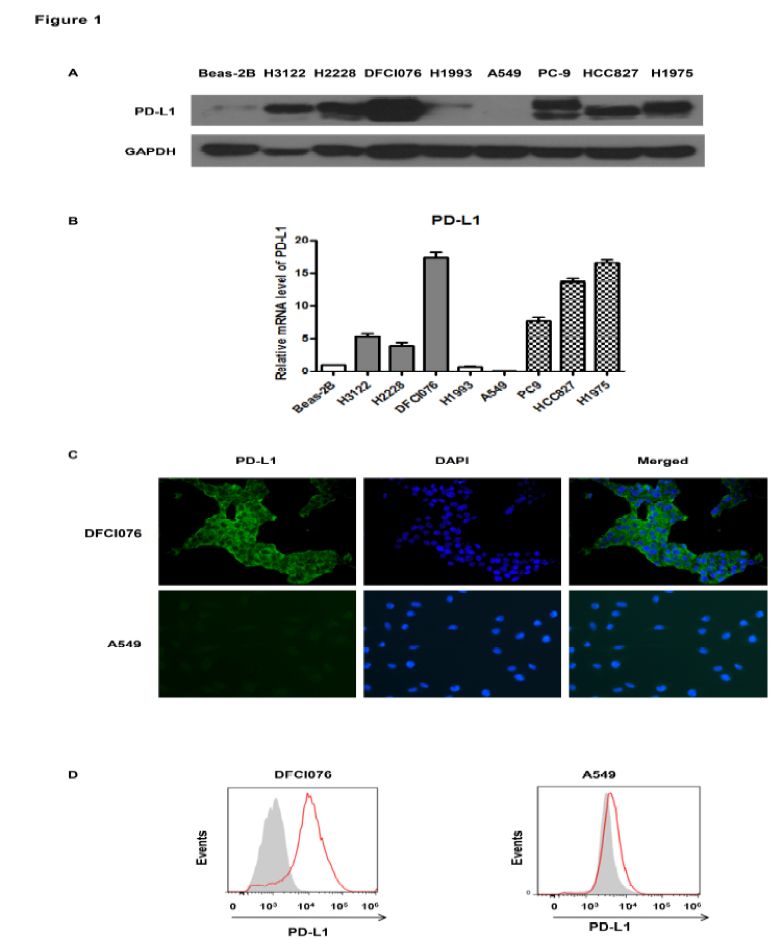
在EML4-ALK融合(H3122,H2228和DFCI076)和EGFR突变(PC9,HCC827和H1975)的NSCLC细胞株中,PD-L1表达水平显著高于EGFR/ALK野生型细胞株(A549,H1993)或永生化的人肺支气管上皮细胞株(Beas-2B细胞),见图1A,检测PD-L1 mRNA水平观察到相似的结果,见图1B。研究者同时采用免疫荧光来定位DFCI076细胞株(PD-L1相对高表达)和A549细胞株(PD-L1相对低表达)PD-L1表达,DFCI076细胞株中细胞膜和细胞质中均显示出PD-L1强信号,见图1C。此外,A549和DFCI076细胞株中PD-L1不同表达水平进一步被流式细胞术确认,见图1D。
图1. 人NSCLC细胞株中,PD-L1表达与EML4-ALK重排和EGFR突变状态相关
2. EML4-ALK过表达可诱导PD-L1表达
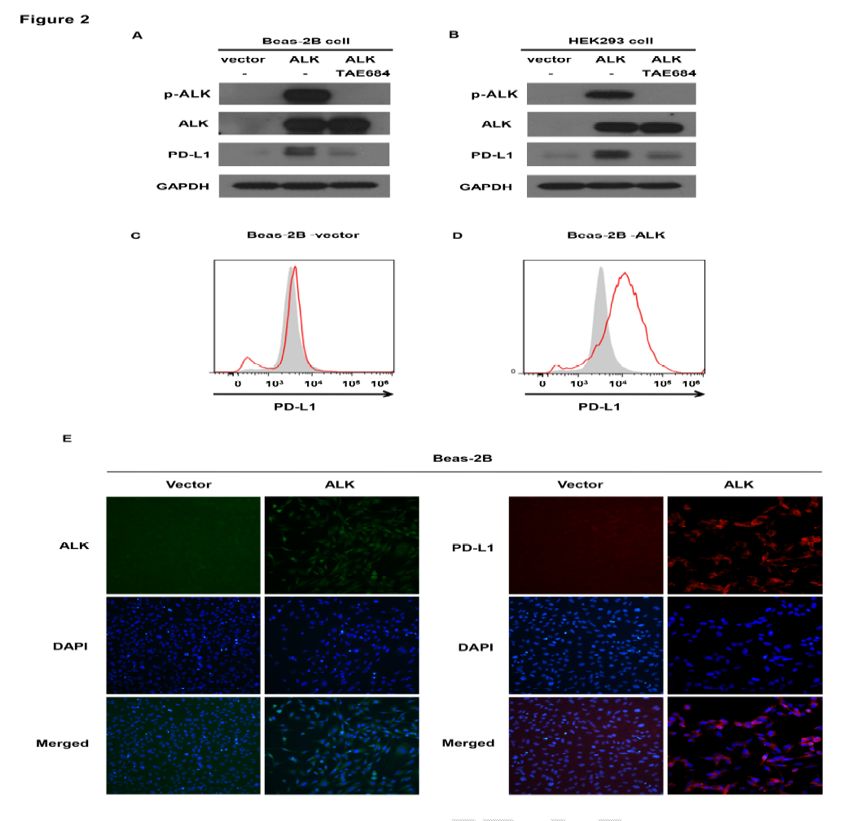
在永生化的人肺支气管上皮细胞系Beas-2B细胞和HEK293T细胞中构建EML4-ALK(V1)过表达的质粒。研究者发现外源性EML4-ALK(V1)蛋白可以诱导PD-L1表达,且采用选择性的ALK抑制剂TAE684可以抑制由EML4-ALK(V1)蛋白诱导的PD-L1表达,见图2A和2B。由EML4-ALK(V1)蛋白诱导的PD-L1表达进一步在流式细胞术中得到确认,见图2C和2D。最后,研究者采用免疫荧光来显示EML4-ALK(V1)和PD-L1表达的关系。EML4-ALK(V1)融合蛋白和PD-L1均在EML4-ALK(V1)过表达的Beas-2B细胞膜上表达,见图2E。上述结果提示外源性的EML4-ALK过表达可以诱导PD-L1表达。
图2. 外源性的EMK4-ALK(V1)过表达可以诱导PD-L1表达
3. 抑制EML4-ALK可以下调PD-L1表达
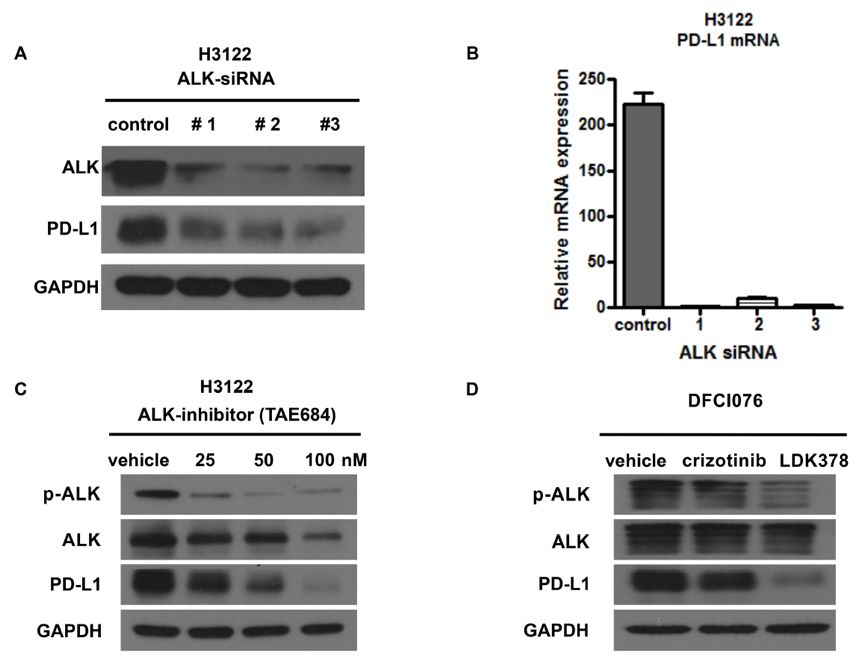
因为外源性EMKL4-ALK(V1)蛋白可以诱导PD-L1表达,因此阻断ALK可能可以抑制ALK融合的NSCLC细胞株上PD-L1表达。研究者首先使用3个不同的靶向ALK-siRNAs来敲除ALK表达。如图3A所示,所有的ALK-siRNAs均可以显著下调ALK表达,此外,敲除ALK后PD-L1表达的下调在mRNA水平也得到确认,见图3B。接下来,研究者采用特定的ALK抑制剂TAE684来抑制ALK活性。与预期一致,ALK活性抑制后,PD-L1表达下调,见图3C。DFCI076细胞携带EML4-ALK融合基因,但对克唑替尼耐药,分别给予克唑替尼和LDK378处理,结果显示,在克唑替尼处理后的细胞中,因ALK激酶活性无变化,因此PD-L1表达没有改变;但LDK378可以显著抑制ALK活化,从而可以下调PD-L1表达水平,见图3D。综上可知,抑制NSCLC中EML4-ALK融合蛋白可以下调PD-L1表达。
图3. 抑制EML4-ALK可以下调PD-L1表达
4. EML4-ALK通过p-ERK1/2和p-AKT通路而非p-JAK3通路调节PD-L1表达
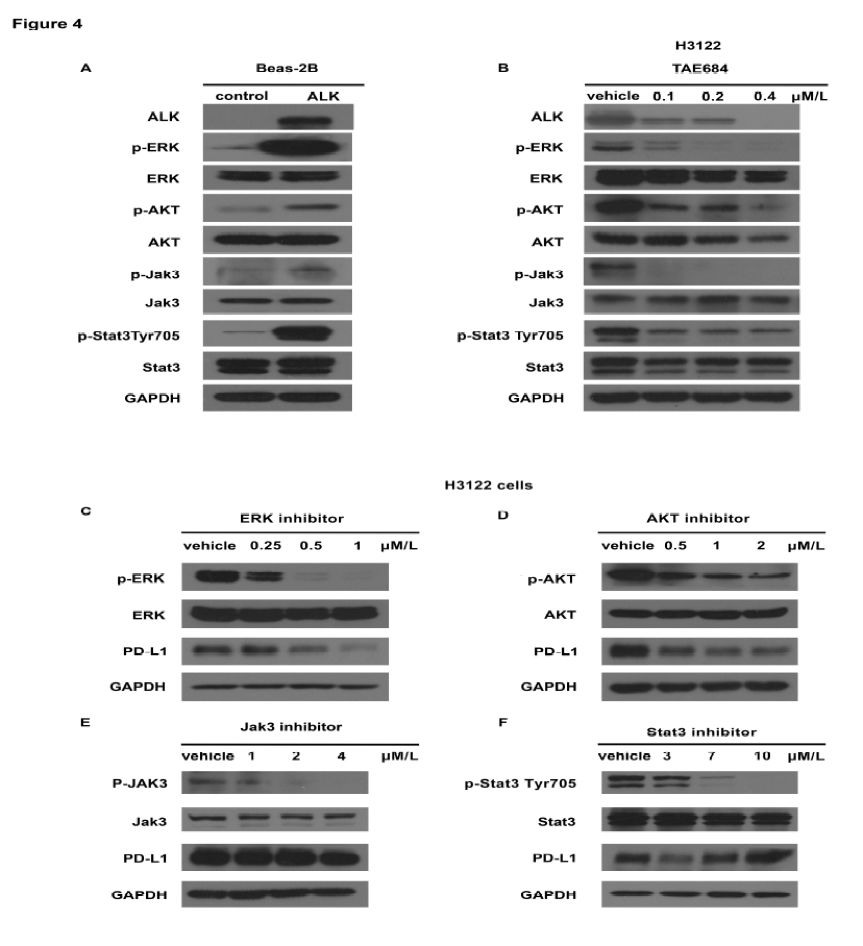
研究者进一步探索了ALK诱导PD-L1表达的信号通路。见图4A和4B,EML4-ALK融合蛋白可以激活pERK1/2,p-AKT和p-Stat3,且TAE684可以抑制其活化。此外,研究者采用ERK1/2,AKT1/2/3,JAK3和Stat3抑制剂阻断EML4-ALK的下游通路,结果显示,ERK1/2抑制剂(SCH772984)可以有效抑制pERK1/2,导致PD-L1表达下调,见图4C;此外,AKT1/2/3抑制剂(MK-2206 2HCL)也可以有效抑制p-AKT1/2/3表达,诱导PD-L1表达下调,见图4D。然而采用JAK3抑制剂或STAT3抑制剂处理后,p-JAK3或p-Stat3表达无变化,PD-L1表达也无变化,见图4E和4F。这些结果提示,EML4-ALK通过p-ERK1/2和p-AKT通路而非p-JAK3通路调节PD-L1表达。
图4. EML4-ALK通过p-ERK1/2和p-AKT通路而非p-JAK3通路调节PD-L1表达
5. 由EML4-ALK蛋白诱导的PD-L1表达可以通过PD-L1/PD-1通路诱导T细胞凋亡
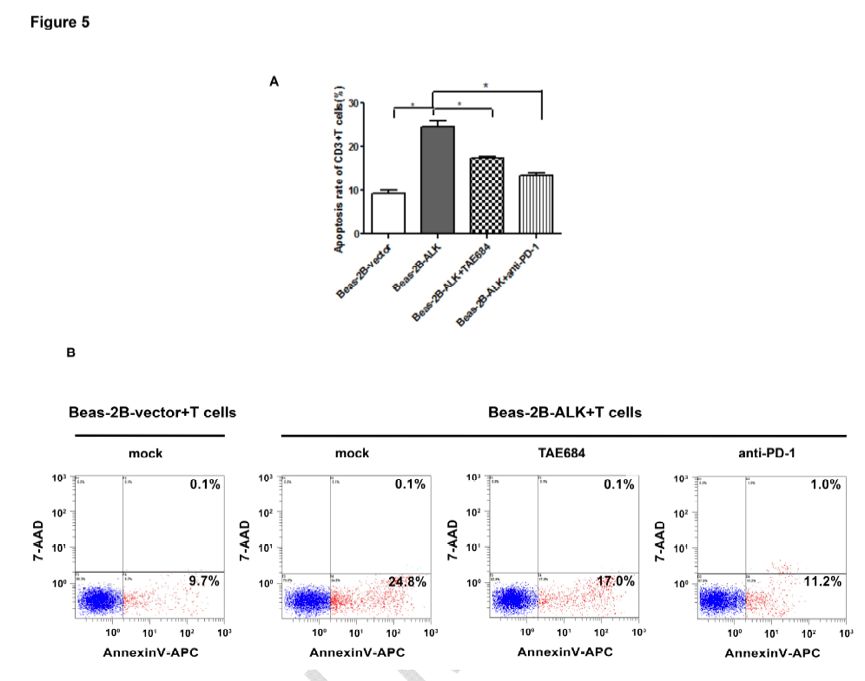
PD-L1/PD-1信号通路可以抑制或诱导T细胞凋亡,采用抗PD-L1/PD-1单抗可以逆转这一作用。为进一步探索通过EML4-ALK融合蛋白诱导的PD-L1表达上调是否同样影响T细胞功能,研究者共培养了DC-CIK和Beas-2B-EML4-ALK(V1)或Beas-2B-vector细胞。如图2A所示,Beas-2B-EML4-ALK(V1)细胞相比于Beas-2B-vector细胞,PD-L1表达水平更高。与Beas-2B-EML4-ALK(V1)细胞共培养的CD3+T细胞的凋亡率高于与Beas-2B-vector细胞共培养的T细胞(24.9±3.4% vs 9.8±1.0%,P<0.05),见图5B。在Beas-2B-EML4-ALK(V1)/DC-CIK共培养系统中,采用抗PD-1/L1单抗治疗,可以降低T细胞凋亡率至12.2±1.7%(P<0.05)。接下来,研究者采用TAE684来下调由EML4-ALK介导的PD-L1表达,结果显示T细胞凋亡率下降至17.1±1.3%(P<0.05,见图5B)。上述结果显示,由EML4-ALK蛋白诱导的PD-L1表达可以通过PD-L1/PD-1通路诱导T细胞凋亡。
图5. 由EML4-ALK蛋白诱导的PD-L1表达可以通过PD-L1/PD-1通路诱导T细胞凋亡
6. 在EML4-ALK融合的NSCLC中应用ALK抑制剂可以下调PD-L1表达,解除T细胞抑制
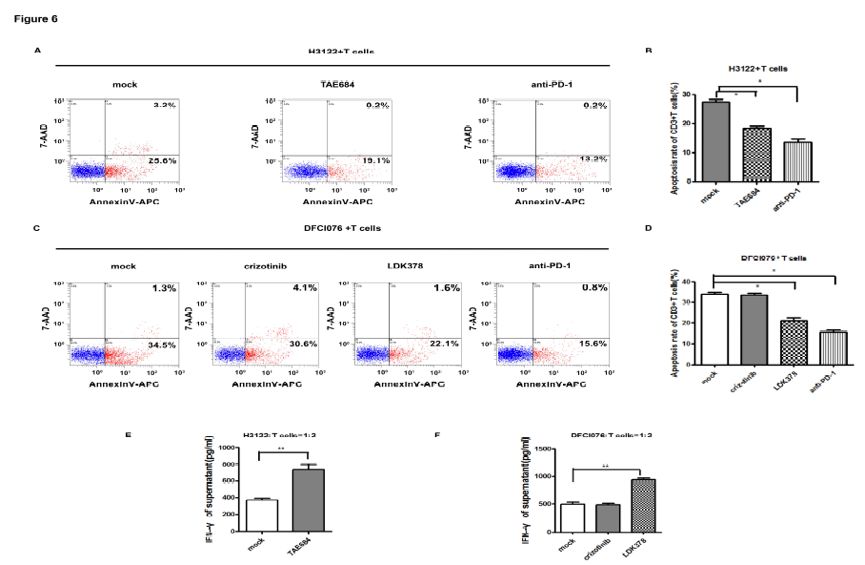
为探索采用ALK抑制剂抑制EML4-ALK表达是否可以逆转T细胞凋亡,研究者共培养了H3122细胞和DC-CIK细胞,结果显示在H3122/DC-CIK共培养系统中,T细胞凋亡率由28.8±1.4%下降至19.3±1.5%(P<0.05),见图6A和B。在DFCI076/DC-CIK共培养系统中,LDK378可以将T细胞凋亡率由35.5±2.3%下降至23.7±3.4%(P<0.05),然而,克唑替尼并不影响T细胞凋亡率(P=0.7),见图6C和6D。当DC-CIK细胞与H3122或DFCI076细胞共培养时,阻断PD-1可以逆转T细胞凋亡(13.4±2.1%和16.4±1.9%,P<0.05),见图6A和6C。
当T细胞和EML4-ALK阳性的NSCLC细胞株共培养时,ALK-TKIs是否可以影响T细胞的免疫功能?研究者收集了共培养物上清进行IFN-γ分析。结果显示,在H3122/DC-CIK细胞共培养系统中,TAE648处理后IFN-γ显著升高。与预期一致,克唑替尼并不影响IFN-γ水平,而LDK378可以显著增加DFCI076/DC-CIK细胞共培养系统中IFN-γ的产生,如图6E和6F。这些结果提示,采用敏感的ALK抑制剂抑制ALK活性可以通过增加IFN-γ浓度逆转T细胞凋亡。
图6. 采用ALK抑制剂抑制ALK蛋白可以解除T细胞抑制
7. 抗PD-1或ALK抑制剂可以抑制EML4-ALK融合的NSCLC细胞株生存
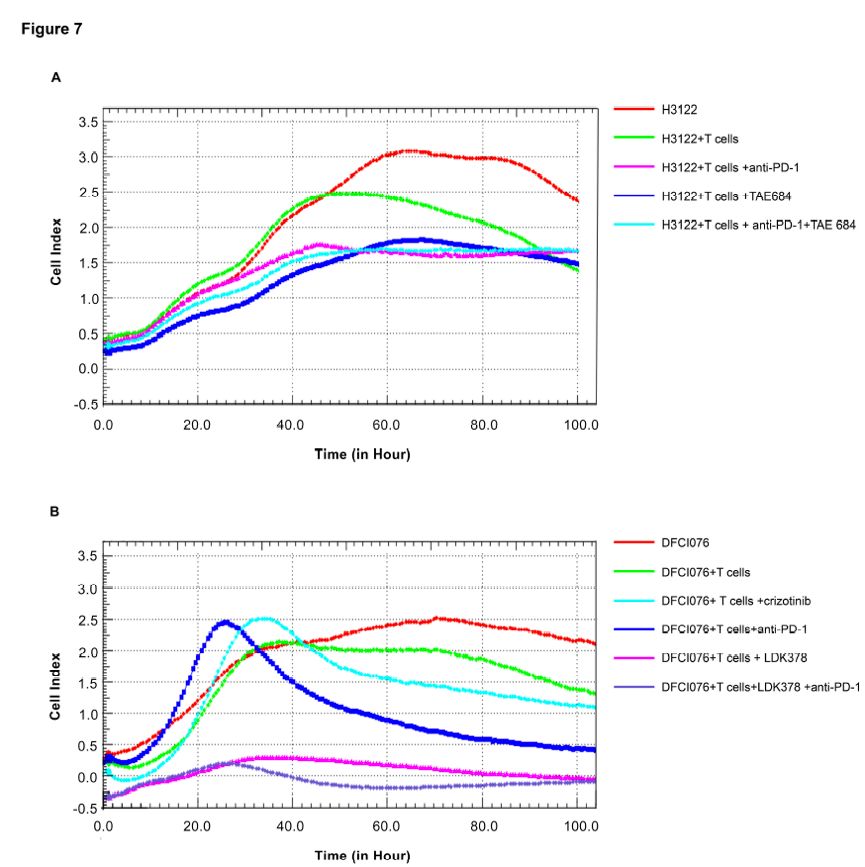
上述研究结果显示,抗PD-1或采用敏感的ALK抑制剂抑制EMK4-ALK可以解除T细胞抑制。为进一步评估抗PD-1或ALK抑制剂对DC-CIK和肿瘤细胞共培养体系的影响,研究者检测了肿瘤细胞的实时生存信号。细胞指数代表肿瘤细胞的生存率。采用抗PD-1单抗和/或ALK抑制剂处理肿瘤细胞和DC-CIK细胞共培养系统,结果显示,阻断PD-1可以降低H3122细胞和克唑替尼耐药的DFCI076细胞的生存。TAE648处理后,可以降低H3122细胞而非DFCI076细胞的生存。然而,LDK378显著降低DFCI076细胞的生存率。接下来,研究者进一步探索了ALK抑制剂联合抗PD-1单抗是否可以抑制共培养系统中肿瘤细胞的生长,结果显示,ALK抑制剂和抗PD-1单抗未显示出协调抗肿瘤效应,图7A和7B。上述结果显示,抗PD-1单抗或敏感的ALK抑制剂可以激活T细胞的抗肿瘤免疫,降低克唑替尼敏感和耐药的NSCLC细胞与DC-CIK共培养系统中肿瘤细胞的生存率。
图7. 抗PD-1或ALK抑制剂可以抑制EML4-ALK融合的NSCLC生存
结论
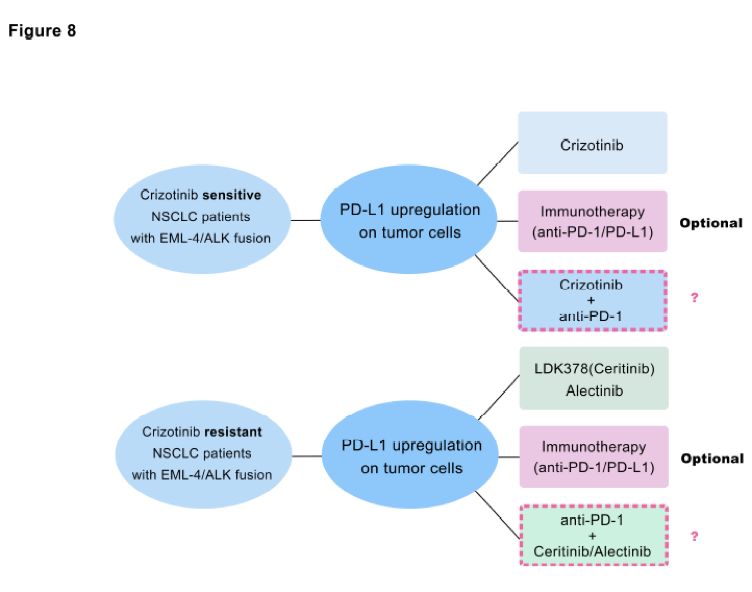
本研究系统性阐述了NSCLC中EML4-ALK融合基因介导的PD-L1表达上调。此外,研究发现由EML4-ALK融合蛋白介导的PD-L1表达上调可以诱导T细胞凋亡,这一过程可以被ALK-TKIs逆转。研究还发现由EMK4-ALK融合基因介导的PD-L1表达上调可以介导NSCLC的免疫逃逸,这就提示,对于ALK TKI耐药的EML4-ALK重排的NSCLC,抗PD-1/L1单抗治疗可能是由前景的治疗选择。
图8. EML4-ALK重排的NSCLC潜在治疗模式
点评
本研究在体外实验中系统性探索了EML4-ALK重排的NSCLC细胞可以介导PD-L1表达的上调,实现免疫逃逸,通过采用ALK TKI或抗PD-1/PD-L1单抗治疗可以解除T细胞抑制。因此,对于ALK阳性的NSCLC患者,可能可以从抗PD-1/PD-L1单抗治疗中获益。尤其是对于ALK TKI耐药后的患者,若缺乏有效的治疗手段,可以考虑免疫检查点抑制剂治疗。研究未发现ALK TKI与抗PD-1/PD-L1单抗存在协调作用机理,两药是否适合联合使用,仍有待进一步的研究探索。
扫描二维码阅读原文
Up-regulation of PD-L1 by EML4-ALK fusion protein mediates the immune escape in ALK positive NSCLC: implication for optional anti-PD-1/PDL1 immune therapy for ALK-TKIs sensitive and resistant NSCLC patients. Oncoimmunology 2016;5(3): e1094598.
41本肿瘤患者指南丛书
点击下方图片即可免费阅读
28个肿瘤相关临床试验招募患者
点击下方图片即可查看详情