今日PNAS: MIT赵选贺团队再生人体器官内褶皱组织
海归学者发起的公益学术平台
分享信息,整合资源
交流学术,偶尔风月
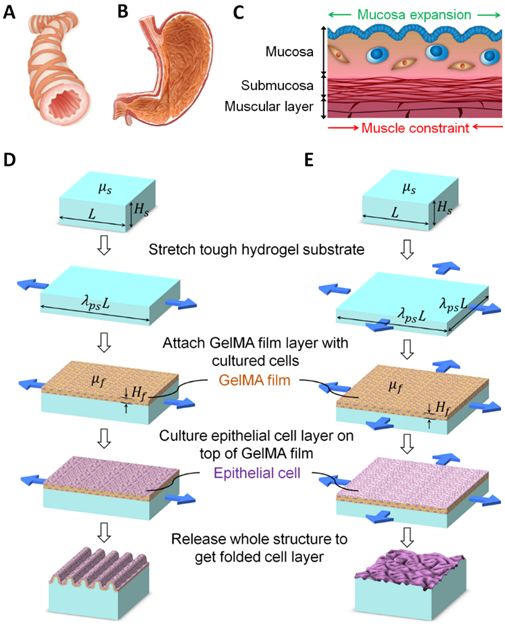
生物粘膜大量存在于人体器官中,例如气管粘膜,食道粘膜,胃粘膜,小肠粘膜,子宫内膜等等(图一A,B)。这种粘膜是生物器官内形成腔体并且覆盖内部器官的重要组织,其生理结构包含一层或多层的表皮细胞覆盖在富有基质细胞的粘膜(图一C)。大部分的生物粘膜都具有一定的表面褶皱形态(图一),例如管状器官的粘膜体现出一维的褶皱形态,腔体的粘膜体现出二维的褶皱形态。
这些褶皱在人体器官内有重要功能:第一,增大表面积促进生物组织对营养与水分的吸收,第二,使腔体实现不同程度上的膨胀而不会引起因为过量拉伸产生的损坏,第三,有些表面褶皱具有开放与闭合腔体的作用来实现腔内流体与固体的通过和阻拦。在现在蓬勃发展的医学领域,尤其是生物工程与组织工程学领域,制备具有功能性的人造器官和组织来替换或修复受损的生物器官组织一直是一个难以攻克的问题。现阶段制备人造器官的方案仍局限在利用3D打印或者模具成型的方式来仿制器官的总体大小与形态,这些开发方案往往无法使器官内褶皱的粘膜具有灵活收缩/舒张的功能,进而无法使人造腔体具有明显体积改变的重要功能。
为解决上述局限和挑战,麻省理工学院 (MIT) 赵选贺团队首次利用力学模型指导了功能性人造生物褶皱组织的制备 [Folding artificial mucosa with cell-laden hydrogels guided by mechanics models. pnas.1802361115]。为了很好的制备具有功能性的器官内褶皱组织,我们首先需要了解产生褶皱的机理。在器官组织的生长过程中,多层结构的生物粘膜具有不同层在模量与生长速率的差别,一般粘膜的外层(腔体壁)相较于内层具有更高模量以及生长速率。这些层间的差异导致了力学失稳的产生,从而使生物粘膜体现出不同程度的褶皱。这些褶皱的形成使残余应力被保留在粘膜结构中,因此在器官腔体受到外界加载(压力升高或大量流体固体通过)时粘膜可随着残余应力的释放而舒张开来,在不损害组织的前提下保证了器官灵活的体积变化。
依据上述褶皱组织产生的生物机理,赵选贺团队在该工作中提出了一种由力学指导的机械式人造功能性褶皱组织的制备方式(图一D,E)。首先将高韧水凝胶拉伸至特定预应变,然后将培养有基质细胞的水凝胶粘膜交联与预拉伸的水凝胶表面。之后在上表面培养一层表皮细胞以用来准确复制粘膜组织的生理结构。接着,整个系统被释放到无外界加载状态,至此,人造粘膜因为力学失稳而产生表面褶皱。当控制单向的预拉伸应变时,可以得到类似气管粘膜的一维褶皱,当控制双向的预拉伸应变时,可以得到类似胃腔粘膜的二维褶皱。
图一:人体器官内膜的褶皱形态,结构及文章提出的人造功能性器官的制备方式。A,人体气管内膜体现出一维的褶皱形态。 B,人体胃腔内膜体现出二维的褶皱形态。C,粘膜-下粘膜的生理结构及细胞种类。D,E,人造一维及二维褶皱粘膜的制备方法可兼容真正内膜的细胞类型。
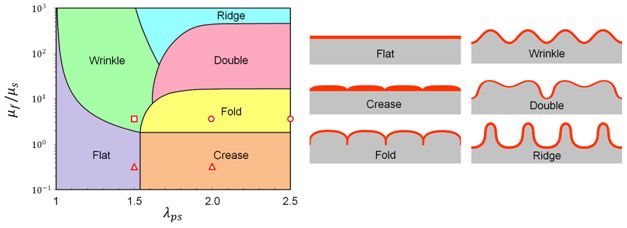
由于人造褶皱组织的表面形态,包括波长,高度,以及厚度都需要准确仿制出器官中的粘膜褶皱的形态特征,我们需要精确的力学模型来指导实验制备中材料参数的选型和加载的控制。通过现有的力学模型与表面形态相图(图二)[JAM, 84(8), p.081001 (2017)]可以得出,人造褶皱组织的表面形态是由褶皱组织双层结构的模量与预应变差异决定的。为了实现仿特定褶皱的形态,团队参照表面形态相图选择了相应的双层结构模量比值及基底水凝胶的预拉伸应变。材料的模量的控制可通过在实验中调整化学配比的方式实现。
图二:双层结构的表面形态相图。通过控制双层结构的模量比和预应变差异,人造粘膜结构可实现不同的图示中的表面形态。 图中表明的空心点为实验中尝试的不同参数组合,具体请参照原文。
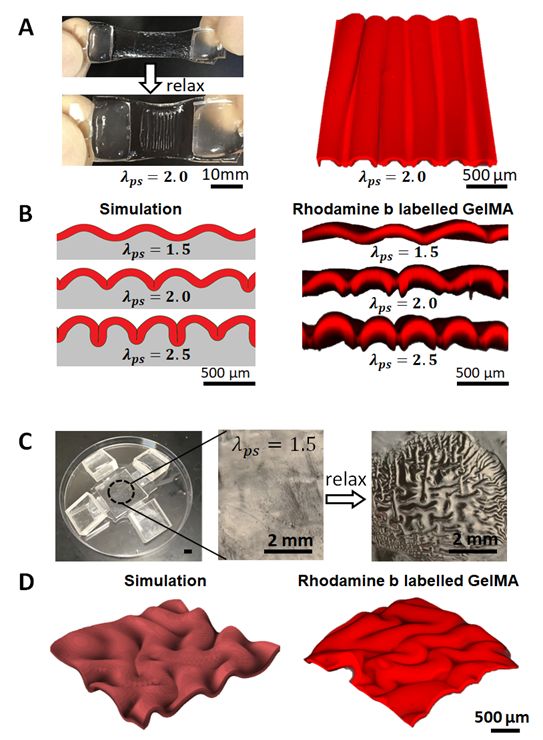
依据表面形态相图提供的双层结构模量比值和预应变差异, 团队用双层结构的水凝胶仿制出具有特定褶皱的一维组织形态, 并可实现灵活的收缩/舒张(图三A)。我们利用共聚焦显微镜纪录褶皱的三维结构。在制备过程中,通过力学模型指导,我们可以实施不同的预应变差异来模拟和实现不同的表面形态(图三B-D)。当我们将水凝胶双向拉伸至特定预应变,然后把人造褶皱组织交联于预拉伸的水凝胶表面,并释放至无外界加载状态,可以得到类似胃腔粘膜的二维褶皱结构(图三C, D)
图三:力学指导的一维与二维褶皱组织的制备。A,B,一维褶皱组织的实验制备及模拟和实验结果对比。C,D,二维褶皱组织的实验制备及模拟和实验结果对比。更多信息参照原文。
组织工程学 (Tissue Engineering)
传统的组织工程技术利用表面平坦的支架构建胃肠道组织,无法复制褶皱的结构。目前现有的技术, 如让上皮细胞在预制图案的表面或基底上生长或使用3D 打印技术,都不能很好的模拟出由于残余应变所引起的褶皱组织的折叠过程。通过力学指导的方式,赵选贺团队首次制备一维和二维褶皱粘膜组织。人造功能性粘膜利用具生物相容性的水凝胶培养基质细胞和表皮细胞,模拟褶皱组织的生理结构。由此该技术在组织工程领域中给出了一个简单而新颖的范例,让该技术可以广泛的应用于各种器官组织的修复和再生。
器官芯片 (Organ-on-a-chip)
器官芯片在药物筛选,研究人体器官的生理、病理活动等领域正在被广泛利用。人体内的胃肠道器官大多具有褶皱的粘膜。由于和人体粘膜有相似的生理結構、力学性质以及很好的生物相容性等优点,此褶皱粘膜可应用于生物芯片中用以模拟人体胃肠等器官动态环境。在器官芯片上制备这些褶皱粘膜可以更有效的模拟各器官的功能,包括肠胃蠕动,药物吸收等。
生物组织型态形成(Morphogenesis)
生物组织的形成是一个多层次的构造过程, 包括分子, 细胞及组织水平上的生化、物理等多重因素相互作用。目前研究形态形成受限于使用动物试验平台, 对于理解不同因素之间的相互作用,和如何影响组织形态发育方面存在一定难度。由此,赵选贺团队首次证明:基于力学失稳原理, 可以制备具有一定功能性的器官内褶皱组织, 该技术有助解释粘膜褶皱形成所需要的条件。
力传导(Mechanotransduction)
在发育的过程中, 机械力可透过细胞骨架、细胞表面接受器等将力学信号传递并转换成生化信号, 从而改变细胞的大小, 形状, 位置和基因表达等特征。褶皱组织会受到外界的拉伸, 而此过程所产生的力学刺激如何影响表皮和基质细胞还是未知。由此,赵选贺团队提出的方法可用于褶皱组织, 研究褶皱收缩/舒张活动对细胞的影响。
团队介绍
该工作由麻省理工活性软体材料研究室(MIT SAMS lab)主导完成。通讯作者赵选贺博士是MIT终身教授、MIT机械系副教授,以及Robert N. Noyce Career Development 教授。该工作的共同第一作者为香港中文大学的陈汉辉教授与MIT博士后赵芮可。赵芮可博士将在2018年8月正式加入美国俄亥俄州立大学(OSU)机械航天系,现招收博士后与研究生,有兴趣者可将简历发送至rzhao@mit.edu。文章的其他作者有 German A Parada , Hu Meng, Kam W. Leong , Linda G Griffith,具体请参见原文。
点击“阅读原文”可查看论文原文。
扩展阅读
本文系网易新闻·网易号“各有态度”特色内容
媒体转载联系授权请看下方