和肿瘤赛跑,中国新医药的创新速度
编者按:肿瘤,是人类最可怕的杀手。无论是对于普通老百姓还是医生来说,肿瘤都是一个讳莫如深,难以解决的世纪难题。在悉达多·穆克吉的《众病之王:癌症传》中,把人类对抗这个古老病魔的历史写得波澜壮阔,惊心动魄,他是如此描述肿瘤的:“一种古老而神秘的疾病,一篇永不服输的战斗檄文,一场你我无法选择的斗争。”
在人类的抗癌史上,人们对肿瘤的治疗手段在不断的进步,对肿瘤的认知也在不断提高。从最初的手术切除,发展到第二阶段的放化疗,再到现在的靶向药物和免疫疗法,肿瘤的治疗方式在不断进步,肿瘤患者的生存率也在提升。虽然,我们离最终攻克肿瘤还有很远,但是相信技术的进步,会让我们离这个里程碑越来越近。动脉新医药公众号(biobeat1)希望能够用我们的文字,记录创新药、创新治疗、生物领域的发展,为行业的进步,为各种疾病的治愈做出自己的贡献。
虽然已经是1月,但是北京的艳阳照在苏南(化名)的身上,已经有了初春的感觉。在车上,苏南的母亲在整理病历、处方等资料,看看还有没有什么缺失。车停到了一家位于航天桥的药房附近,一个小时之后,苏南和母亲完成了下一个月的免费赠药领取手续走了出来。
她们手上的药品名字是盐酸埃克替尼片,商品名为凯美纳。这是贝达药业于2011年上市的我国具有完全自主知识产权的以表皮生长因子受体激酶为靶标的靶向抗癌药,第一个适应症是晚期非小细胞肺癌。
药盒的左下方印刷有红色的“后续免费用药专供”字样,这是中国医药创新促进会和贝达药业为肺癌患者推出的免费用药活动。项目规定6个月购买埃克替尼满26盒,同时满足肿瘤无耐药、无进展等条件后,就可以申请后续的免费用药。从苏南母亲拿到肺癌复发的诊断报告开始,目前已经吃了两年的埃克替尼,其中一年半为免费用药。
苏南的母亲是在2010年的时候,确诊为右下肺中分化腺癌IV期的。“那是一个普通的夏日,平时身体健康的母亲晚上突然觉得胸口痛,第二天我们兄妹两人赶紧送去医院检查,最后CT结果显示极有可能是中晚期肺癌。”苏南回忆起当时母亲刚患病的时候,心情很平静。“可当时完全不是这样,兄妹两人抱头痛哭,感觉天都要塌了。晚期肺癌在我们的心目中,是无法治疗的绝症。”
虽然在2010年,进口靶向药阿斯利康EGFR激酶抑制剂(TKI)吉非替尼(易瑞沙)已经在国内上市,但是极其昂贵的价格并不是大多数患者治疗的第一选择,单月药费接近2万,普通家庭无法承受。
苏南也同样因为费用的原因,首先为母亲选择了手术治疗的方案,配合化疗完成了第一阶段的治疗。手术完成后,苏南母亲的状态非常不错,时常和朋友各地旅行散心,也忘记了曾经患过肿瘤这回事。
2016年,苏南母亲复查发现肺结节,确诊肺癌复发。好在这个时候,国产的靶向药埃克替尼已经上市,价格要远远低于吉非替尼。在医生的推荐下,苏南母亲开始了靶向治疗。而且在半年购买6万多的药品之后,后续的免费赠药项目也大大减轻了苏南的经济压力。
苏南母亲虽然不幸罹患肺癌晚期,但是医学手段的进步延长了她的生存时间,从2011年起一直在带癌生存。这是一个现实版的《我不是药神》的故事,但是和电影中结局不一样的是,国产创新药的出现和国家医保政策的支持,延长了苏南母亲的生命,挽救了苏南的家庭。虽然母亲的肺癌并没有完全根治,但是至少没有进展变得更严重。
2017年,埃克替尼降价超过50%,2018年,包括凯美纳在内的17种抗癌药物纳入国家医保目录,治疗费用的大幅度降低让更多的肺癌患者能够用得起靶向药。
首款国产靶向抗癌新药诞生
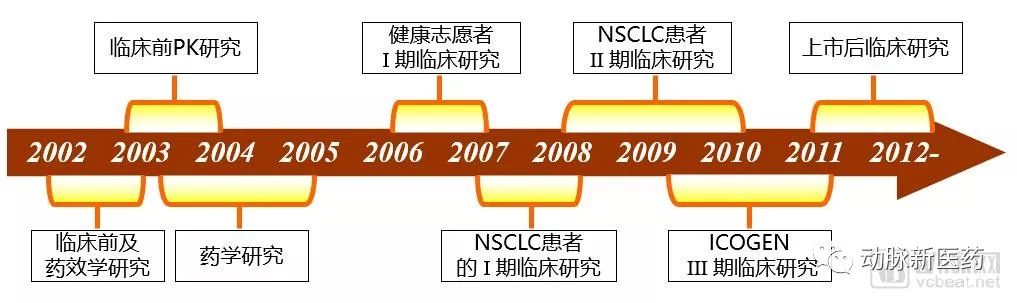
2002年,贝达药业的三位创始人丁列明、张晓东、王印祥,带着美国的设想和创新设计回国创业。王印祥博士在研究易瑞沙和特罗凯化学结构的基础上,找到了EGFR激酶抑制剂的化学结构通式。在此基础上,经过一系列筛选,发现了埃克替尼这一新的结构式。2003年1月,贝达药业在杭州成立,公司名来自于“Better Medicine,Better Life”。
在经历了前期的基础药学、细胞学、酶学、动物学等方面研究之后,埃克替尼来到了临床试验阶段。贝达药业团队基于药品的信心,想要联系北京协和医院主持临床试验。但是作为国内知名医院,协和有非常多的临床试验项目在进行,贝达药业当时也并不为人知,试验请求屡次被拒。
最后,王印祥博士和丁列明博士凭着一股执着的精神和深厚的专业知识,说服协和医院接下了这个项目。2006年,埃克替尼的临床试验同时在北京协和医院和浙大附属医院展开。
临床试验能力的缺乏,是中国创新药研发过程中最大的痛点。在中国,由于高质量的临床试验资源匮乏、审批流程和院内机制不灵活等原因,国内临床试验普遍出现进度滞后。临床试验机构的资质认证和临床试验的审批制度复杂,企业缺乏经验丰富的医学官,临床机构缺乏从事临床研究的人才布局,一定程度上制约着创新药领域的快速发展。
虽然贝达药业在早期临床试验阶段,便设计了一套完备、有说服力的试验方案,最终通过医院、病人、企业三方的配合,把埃克替尼的试验结果做得非常出色,但是整个试验方案的推进也是一波三折。除了初期的临床试验艰难获得协和医院的支持,后期试验也遇到了资金链断裂的问题。
埃克替尼在协和医院的健康受试者实验过程进行得非常安全和顺利,紧接着在2007年开展Ⅰ期临床试验。在Ⅰ期试验获得比较好的结果之后,随后的Ⅱ、Ⅲ期试验陆续获批。为了将临床试验做扎实,贝达药业决定在Ⅲ期试验中采用当时已经上市的吉非替尼作为对照组,做1:1头对头随机双盲对照试验。
ICOGEN Ⅲ期临床试验
2008年,埃克替尼的Ⅲ期临床试验启动前,贝达药业的管理团队既没有选择和生物类似药的头对头,也没有选择安慰剂对比,而是选择了吉非替尼。他们认为这样的方案设计会使得试验结果更加有说服力,但也是一个相当大胆的决定。
埃克替尼ICOGEN Ⅲ期临床试验是全球第一个激酶抑制剂互为对照的注册Ⅲ期临床试验,而且会带来巨大的经济压力。当时吉非替尼在国内的售价达到了550/片,整个试验光是购买对比参照的吉非替尼(易瑞沙)投入就在2500万元左右,整个试验成本需要4800万元。这笔钱,对于当时还很弱小的贝达药业来说,无疑是一笔巨大的开销。
以往的头对头试验失败案例非常多,贝达团队和天使投资机构坐在一起,讲述了选择做头对头试验的原因,深夜长谈后最终说服投资机构按原方案进行。2009年1月,埃克替尼的Ⅲ期临床试验正式启动。
当时几乎全国最好的肿瘤医院都参与了这一试验,PI(主要研究者)由中国医学科学院肿瘤医院孙燕院士担任,Co-PI(合作研究者)由中山大学附属肿瘤医院张力教授担任,医科院肿瘤医院石远凯教授任专家委员会主任委员。
全国包括北京、上海、广州、南京、杭州、长沙、西安、重庆、长春等9个城市27家医院参与多中心试验。试验总入组晚期非小细胞肺癌患者400人,历经10个月后在2009年11月13日完成,剔除一例不合格患者后入组总人数399人。埃克替尼组200人,吉非替尼组199人。试验主要观察的指标是无进展生存期PFS、疾病进展时间TTP和不良反应。
同时,贝达药业聘请了国内知名的临床CRO公司泰格医药负责Ⅲ期临床试验,自己也成立了医学部全程参与。甚至为了确保试验质量,王印祥博士和当时公司的另一位高管亲自当起了CRA(临床监查员),亲自负责全国27家医院的临床督查。
临床试验开展后,资金压力一直是丁列明团队的最大问题。作为当时国内创新药的明星项目,科技部“技术创新基金”、“火炬计划”、“863专项计划”,特别是重大新药创制专项资金一直在为贝达药业提供资金支持,但是巨大的缺口仍然无法弥补。特别是2009年金融危机的到来,跨国投资机构资金链断裂,已经无法支持贝达药业接下来的试验工作。
在这个紧要关头上,2010年初,礼来亚洲基金对贝达药业进行了A轮投资,这也是礼来亚洲基金近十年来最重要的一笔投资。此次融资主要用于增强贝达药业的研发产品线,特别是用于完成盐酸埃克替尼在中国的临床研究和注册审批。礼来亚洲基金的投资不仅是资金上的支持,更为贝达药业带来了礼来丰富的市场经验和行业资源。
2010年5月,ICOGEN试验的开盲结果在杭州进行,这是一个令贝达研发团队和临床试验机构异常紧张的时刻。一旦结果不理想,不仅意味着贝达药业近十年的研究心血付诸东流,也意味着投资人、企业、国家的巨大投资打了水漂。
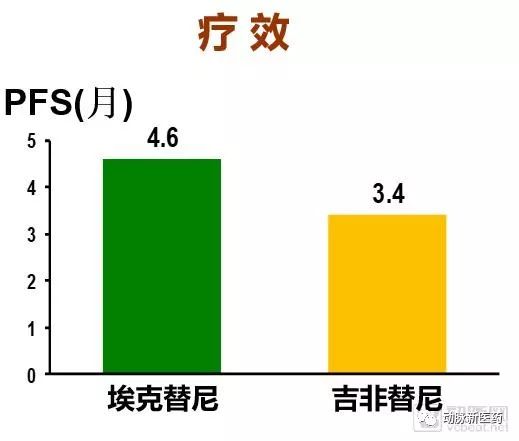
令人兴奋的是,最后的开盲结果显示,埃克替尼具有很好的临床效果,二、三线治疗晚期非小细胞肺癌患者疗效和吉非替尼相当,不良反应更少。
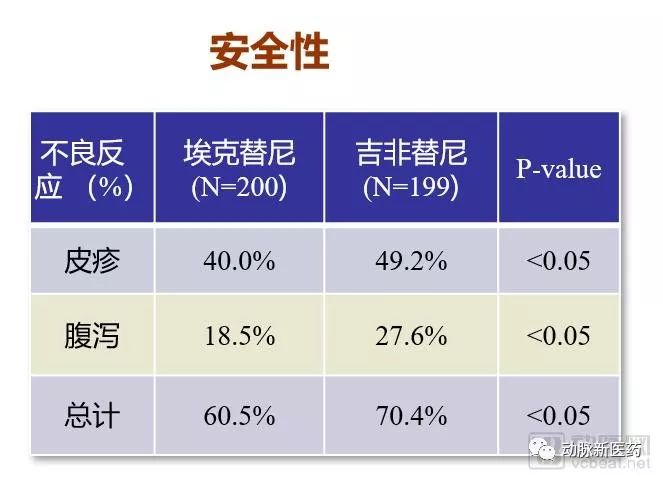
整体曲线相比吉非替尼略高,主要终点PFS(月),埃克替尼为4.6月,吉非替尼为3.4月,中位PFS提高了1.2个月,没有显著的统计学差异。次要终点TTP,埃克替尼中位TTP延长了1.5个月,存在统计学差异。常见不良反应埃克替尼更少,总不良事件统计为60.5%,吉非替尼为70.4%,埃克替尼的安全性更好、患者耐受度更佳。
2011年4月,盐酸埃克替尼正式获得SFDA的生产批文,终于和患者见面。而贝达药业的销售团队也很快组建,1/3的人员来自阿斯利康,2/3来自罗氏,具有丰富的肿瘤药销售经验。他们从临床医生的口中,获得了对埃克替尼的高度评价,也获得了对国产创新药高度的信心。
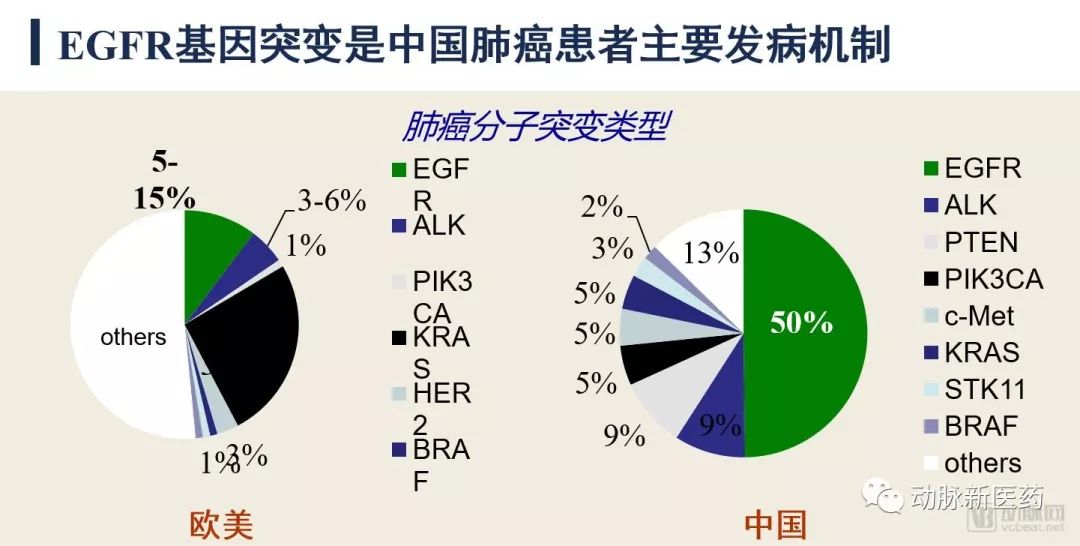
埃克替尼的临床试验选择阳性药物吉非替尼作为对照研究,是一个具有挑战性的决定。在取得Ⅲ期临床试验阳性结果之后,也奠定了这个产品上市以后,在中国临床使用的证据基础。因为在肺癌患者中,中国患者的EGFR突变比例非常高,达到了50%,要远远高于欧美地区。
EGFR高表达、突变的病人对大分子、PD-1药物的效果不好,所以小分子药物是治疗和延续生命的重要选择。中国专家在这个领域创造了很多能够把中国的创新药物推向全球的机会。
所以埃克替尼的研究,开创了中国专家用中国自己的创新药,和国外药物做头对头研究的第一例。
埃克替尼的上市创造了几个第一:全球第一个激酶抑制剂(TKI)互为对照的注册Ⅲ期临床试验;亚洲第一个激酶抑制剂(TKI)靶向抗癌药;中国第一个有自主知识产权的小分子抗癌药;在中国第一次采用进口专利药做头对头双盲对照的Ⅲ期临床试验。埃克替尼在中国以及全世界肿瘤界获得非常大的关注,不仅在疗效上做到了Me-too,还在不良反应上做到了Me-better。
2011年和2012年,孙燕院士在全球肺癌大会上做了试验相关报告,并在美国肿瘤临床大会(ASCO)和欧洲肿瘤年会(ESMO)上接受为参展讨论项目(Poster Discussion )。
2013年8月,由医科院肿瘤医院石远凯教授和中山大学附属肿瘤医院张力教授担任共同第一作者,孙燕院士作为通信作者的埃克替尼Ⅲ期ICOGEN研究结果在国际著名学术期刊《柳叶刀》杂志子刊《柳叶刀肿瘤(Lancet Oncology)》上正式发表。肿瘤学专家Tony Mok和Rebecca S Heist教授评价凯美纳是继易瑞沙和特罗凯之后全球第三个用于晚期肺癌的EGFR-TKI靶向药。
埃克替尼在国内也荣誉不断,被时任卫生部部长陈竺誉为中国医药领域的两弹一星,并入选2011年十一五中国重大科技成就奖,2015年获“国家科学进步一等奖”、2016年获“中国工业大奖”。这是对贝达药业研发团队的肯定,也是对中国创新药所获得的最大褒奖。
从Me-too到Me-first
在吉非替尼上市三年后的2014年,由解放军八一医院的秦叔逵教授与复旦大学肿瘤医院李进教授领衔临床试验,江苏恒瑞医药股份有限公司自主研发的国家1.1类新药阿帕替尼(艾坦)获国家食品药品监督管理局批准正式在中国上市。
阿帕替尼是全球首个获批用于治疗晚期胃癌的小分子抗血管生成药物,其机制主要是通过高度选择性地抑制VEGFR-2酪氨酸激酶的活性,阻断VEGF与其受体结合后的信号转导通路,从而强效抑制肿瘤血管生成,发挥抗肿瘤作用。
2000年,Cell杂志将持续的血管生成列为肿瘤的6大基本特征之一。抗肿瘤血管生成一直是肿瘤治疗领域非常重要的部分。此前,此类药物的Ⅲ期临床研究在胃癌领域均未显示出明显的生存获益。
在中国的胃癌患者中,超过60%比例的患者是中晚期胃癌,五年生存率低。阿帕替尼能够强效抗肿瘤血管生成,从而抑制肿瘤细胞的生长、转移。
2011年1月,阿帕替尼对晚期胃癌的Ⅲ期临床试验在我国胃癌患者中展开。2年多以后的研究揭盲结果显示,阿帕替尼可以显著延长二线治疗失败晚期胃癌患者的生存期和无进展生存期,为二线治疗失败胃癌患者提供了新的治疗选择。
面世4年多以来,阿帕替尼在胃癌领域的显著疗效备受关注,如今阿帕替尼对多种实体肿瘤进行的临床研究探索也显示出良好的疗效前景。
美国临床肿瘤学会年会(ASCO 2018)上,作为中国自主研发创新药的典型代表,小分子抗血管生成靶向药阿帕替尼入选ASCO的49项临床研究,既涵盖了阿帕替尼研究最为成熟的胃肠肿瘤领域,还有我国发病率较高的癌种,如肺癌、肝癌、乳腺癌和卵巢癌,也有骨肉瘤、软组织肉瘤、滑膜肉瘤、胆管癌、神经内分泌瘤、甲状腺瘤等恶性肿瘤。
种种数据表明,基于抑制肿瘤血管生成机制的阿帕替尼,在多瘤种治疗领域呈现出较高的治疗价值。无论是联合化疗,还是联合免疫疗法,抑或单药使用,阿帕替尼都在为不同肿瘤提供新的治疗方向,成为肿瘤治疗中的明星药品。
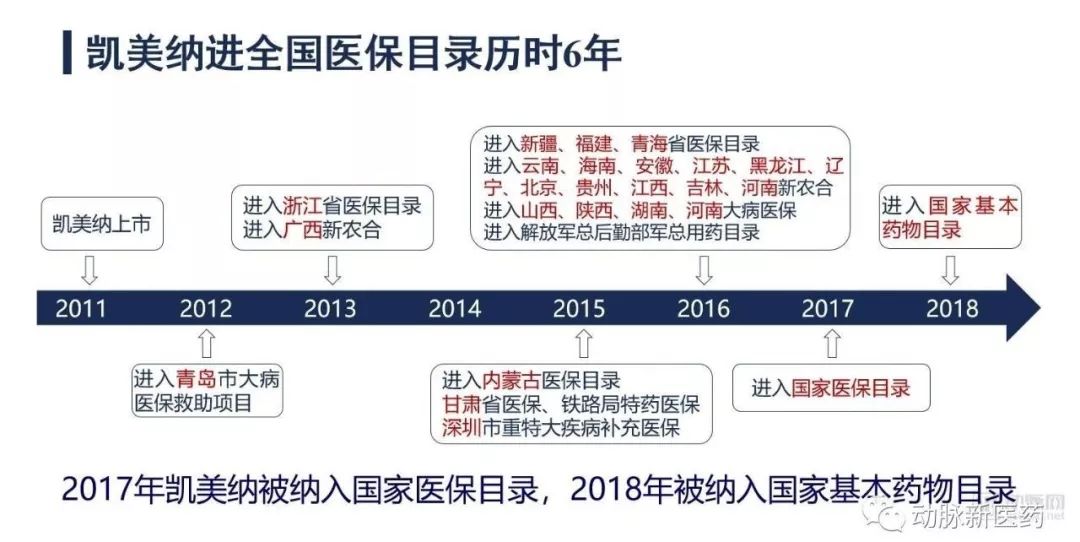
历时六年,国产靶向药终进医保
国产新药的诞生,为苏南母亲这样的患者带来了延长生命的新希望。但是,也需要新药的价格能够让普罗大众所接受。否则,高价专利药仍然会让患者像《我不是药神》中那样,有药买不起,最后只有等死。
2011年,三种EGFR-TKI靶向药埃克替尼(凯美纳)、吉非替尼(易瑞沙)、厄洛替尼(特罗凯)的月治疗费用分别为11800元、16500元和19800元。国产新药在同样疗效的基础上,虽然已经降低了肺癌患者的治疗费用,但是价格仍然偏高。
埃克替尼上市后,贝达药业用相对低价和进口药进行市场竞争,以收回前期的研发成本,赚取利润。但是,贝达药业也如同公司的口号一样,在思考如何能让更多的人用上好药。埃克替尼上市后不久,贝达药业联合药促会,率先推出后续免费用药项目,对于治疗有效患者,可在用药6个月后获得免费用药,减轻其经济负担。同时,贝达药业也在为埃克替尼进入医保进行着努力。
2016年,国家卫计委等16个部委开展首批药品价格谈判,治疗两种疾病的3种药品均降价50%以上。分别是慢性乙肝一线治疗药物替诺福韦酯,非小细胞肺癌靶向治疗药物埃克替尼和吉非替尼。埃克替尼是名单中唯一的国产新药。
最后的谈判结果是,与之前公立医院的采购价格比较,3种谈判药品价格降幅均在50%以上。其中,埃克替尼率先降价54%,拉动了三种药品价格的显著降低。
作为国内自主创新药企的标杆,对于这场始于2015年下半年的国家药价谈判试点,贝达药业在谈判初期即明确提出,埃克替尼在研发初期,得到了国家相当多的支持,将积极配合,并主动表示如果降价与全国医保联动,愿意将埃克替尼的医保零售价大幅下降。
作为此次入围谈判的唯一国产新药,贝达药业此举为政府的药价谈判增添了筹码,帮助政府赢得了主动权。最后普遍降价50%以上的结果显著扩大中国晚期肺癌患者对靶向药物的可及性,也为国家节约了宝贵的医保资源。
随后,2017年2月,埃克替尼进入国家医保目录,2018年被纳入国家基本药物目录,再次降价3.86%,单价1345.05元/盒。进入医保后,月治疗费用降至5700多元,医保患者仅需自付1000多元。
在第二轮国家医保药品谈判中,药品谈判品种进一步扩大,最终完成36个,其中西药中有15个品种是肿瘤、免疫药,阿帕替尼位列第二批名单。价格方面,阿帕替尼通过医保价格谈判降价36.52%,单盒售价1360元。2017年,阿帕替尼正式纳入国家医保目录。
中国创新药的市场困局
虽然埃克替尼和阿帕替尼作为我国的创新药明星,其成就值得大书特书,但是中国的创新药和美国相比还有非常大的差距。《中国药学杂志》2016年4月的统计显示,近15年中国的一类新药只有33个,而美国是413个,两者之间的差距仍旧巨大。
而且中国的新药绝大部分是Me-too,少数是Me-only和Me-better。(Me-too指药物具有相同的作用靶点,相同的活性基团;Me-better指药物具有改良型的作用靶点及活性基团,使改良后的药物疗效和安全性更好。Me-only指药物具有全新的作用靶点作用机制和全新的活性成分。)
制约我国创新药发展的主要瓶颈有两个方面。在研发方面,源头创新少,企业规模小,研发资金的不足和高端人才的缺乏使得我们的研发成果稀缺,在研项目也扎堆在一些主要靶点上。在审批方面,上市审批时间长,国产创新药审批慢于进口药。
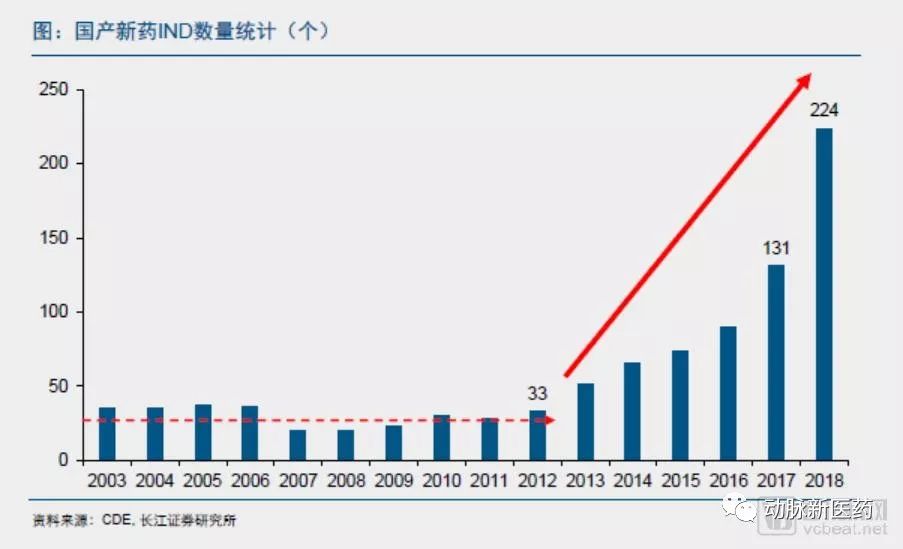
2003-2012年,国产新药临床申请(IND)申报数量每年维持在30个左右的水平。
2012-2018年,国产新药临床申请(IND)数量大幅攀升。2017年,国产IND数量达到131个,同比增长46%;2018年,国产IND数量达到224个,同比增长71%。新药IND的持续增长给创新配套的CRO和CMO带来长期趋势性利好,同时也产生了临床资源的争夺。中国的医药创新已经从仿制开始逐步在往创新方向转变。
2019年,预计国产创新药的获批数量或将进一步增多。
2018年内提交上市申请的国产新药数量达到15个,预计2019年获批的国产新药大概率超过10个。
十多年来,国家在花大力促进新药研发,“重大新药创制”科技重大专项自2008年开始实施。专项在促进创新药研发与医药产业发展、填补国家空白方面获得了一定的成绩。2008年到2018年,新药专项共部署项目(课题)1641项,投入中央财政资金143亿元,新药专项支持的94个品种获得新药证书,催生28个一类新药,比专项实施以前的新药数量提升5倍。
近5年国内生物技术呈现出爆发态势,但相应也带来了更为激烈的红海竞争态势。目前国内生物药同靶点申报的扎堆程度显著超过化学药,既包括以PD-1/L1和CAR-T为代表的一线创新药,也包括以利妥昔、曲妥珠、贝伐珠等为代表的生物仿制药。
中国的创新药在之前很难被国际接受,即使中国在进入ICH之后也是同样的情况。2007年-2015年间,中国首发上市的19个1.1类新药,没有一个在ICH成员国中上市,只有一款药列入Citeline年度新药目录,就是埃克替尼。我们希望后续的中国创新药,能够在研发领域被国际所认可,不管是Me-too还是Me-better,被认可首先是最重要的。
2019年,很有可能成为中国创新药走出国际的元年。目前已经有多个国产创新药处于全球临床Ⅲ期状态,预计在2019年,万春布林的普那布林、百济神州的赞布替尼、贝达药业的恩莎替尼和亿帆医药的贝格司亭均有望在美国提交上市申请或者完成临床试验,标志着国内创新药产业进入一个新的阶段,创新药将从国内走向世界。
加速进口创新药的审批
药审的关键环节为临床研究审批和新药上市审批,从目前审批时间的设置来看,中国的临床研究法定审批时间相对美国、欧盟、日本等国家偏慢。2018年中共中央办公厅、国务院办公厅发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,其中,优先审评模式将大大加速新药上市速度。
优先审批制度对于进口创新药快速进入中国有更大的积极意义。此前,我国现行政策要求进口创新药必须在国外获准上市后才可到中国申请上市。
在中国上市还需要经过申请临床、临床试验、申请上市等环节,一些新药在中国上市平均要比欧美晚 5年到7年。
为解决临床试验审评时间过长这个问题,让申请人尽快进入临床研究,药监局通过改革将临床申请从10个月缩短至60天左右。同时,为了加快审批审批速度,药品审评中心近两年不断扩充审评员队伍,目标是在2020年能够达到1600人审评的队伍。
《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》要求接受境外临床数据,支持拓展性临床试验。因此,国家药品监督管理局组织制定了《接受药品境外临床试验数据的技术指导原则》。对接受境外临床试验数据的适用范围、基本原则、完整性要求、数据提交的技术要求以及接受程度均给予明确。这意味着全球新药在中国上市将节省时间和成本,中国患者将有机会在国内更快合法获得部分特效药,企业研发费用也将有所降低。
2014年,FDA批准两款PD-1单抗Keytruda和Opdivo用于治疗黑色素瘤,这两款药品也于2018年来到了中国市场。默沙东公司的PD-1抑制剂帕博利珠单抗注射液(中文商品名可瑞达,英文名Keytruda)从CDE受理申请到获批上市,只花了5个月时间,堪称神速。另外,阿斯利康的奥西替尼,总共只花了7个月的时间完成审批。而作为对比的国产吡咯替尼(恒瑞医药)和呋喹替尼(和记黄埔)总共花了12个月和14个月完成审批,国产创新药审批略慢于进口药。
默沙东公司的Keytruda在中国市场从审批到上市的速度在加快,另一方面药品的市场推广速度也堪称完美。从药品审批完成到商业上市,从商业上市到快速铺货,以及病人快速使用这款药品,环环相扣。
2009年,默沙东合并了先灵公司,虽然先灵的名字没有保留下来,但是它的肿瘤产品线为默沙东带来了前所未有的贡献。
早在进入中国市场前,Keytruda就已在美国功成名就,它治愈了患晚期黑色素瘤的美国前总统卡特,也是首个成功跻身肺癌一线治疗的免疫治疗药物、成功征服美国FDA一次获批15种肿瘤适应症等。
Keytruda是医药史上第一款没有按照肿瘤部位批准的药物,不管肿瘤的原发病灶在哪里,只要存在高微卫星不稳定性(MSI-H)或错配修复缺陷(dMMR),就都可以使用Keytruda进行治疗。
Keytruda在进入中国市场时,第一个适应症仍然和美国一样是以恶性黑色素瘤开始的,单臂临床试验很快完成。2018年7月20日递交CDE,总共只花了164天就完成了审批。
虽然所有的大分子药品必须在得到获批以后才能生产,但是默沙东通过在中国生产大分子药物十多年的经验,只用了63天,就完成药品的清关、包装设计、灌装和药检。
得益于默沙东在前期的准备工作,空运、公路运输等环节的无缝对接,9月21日下午三点多药检报告出来那一刻,Keytruda从仓库来到第一个病人手中,只花了67分钟就到达了病房。24小时,Keytruda在国内的销售额就达到了1亿元人民币。
肿瘤创新药成为新一轮研发热点
创新药研发的本质是解决未被满足的临床需求,同时创新药的发展与疾病谱的变迁紧密联系。攻克心脑血管疾病的创新药周期已经完成,现在迎来的将是以肿瘤为周期的新一轮创新药周期,也为投资者和创业者带来了前所未有机遇和挑战。
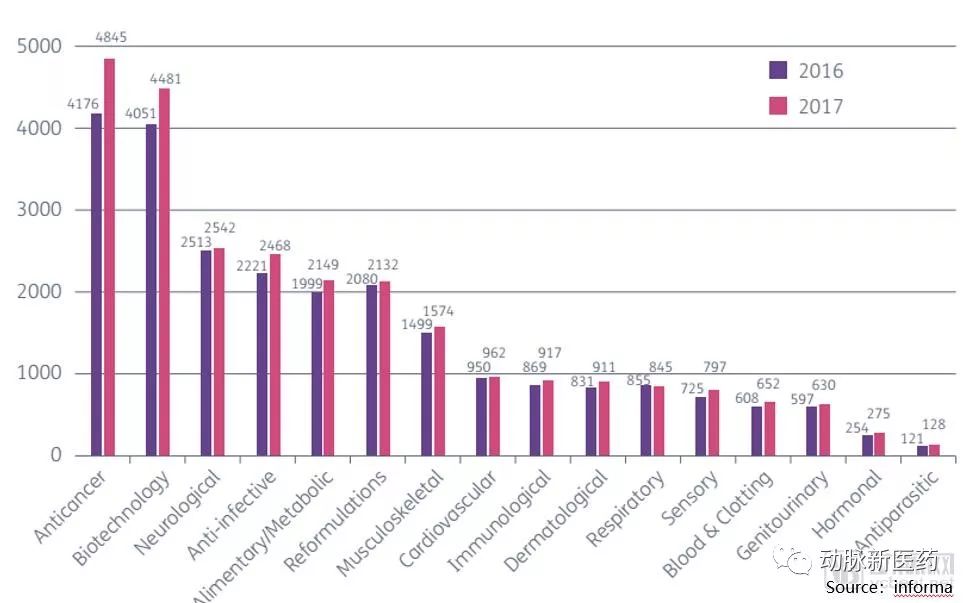
一组数据显示,目前的新药管线中,肿瘤占据了相当大的比例。2017年的管线数量为4,845个,约占全部管线的1/3,而且相对2016年同比增长16%。虽然肿瘤创新疗法绝大部分被国外的药品和技术所占据,但中国本土企业在这一轮创新周期中也萌发了自己的创新力量,为攻克这种不治之症贡献着自己的力量。
以攻克肿瘤为周期的这一轮周期正在开启黄金时代,使之从绝症往慢性病转换是未来10-15年医药人的主要任务。
另一方面,市场需求、技术进步、人才积累、政策和资本支持造就了国产创新药发展的基础,创新药将是未来医疗领域非常大的投资机会。在贝达的案例中,我们看到了资本对其前期研发、临床试验中的帮助非常大,离开资本,研发成果无法转化为市场。
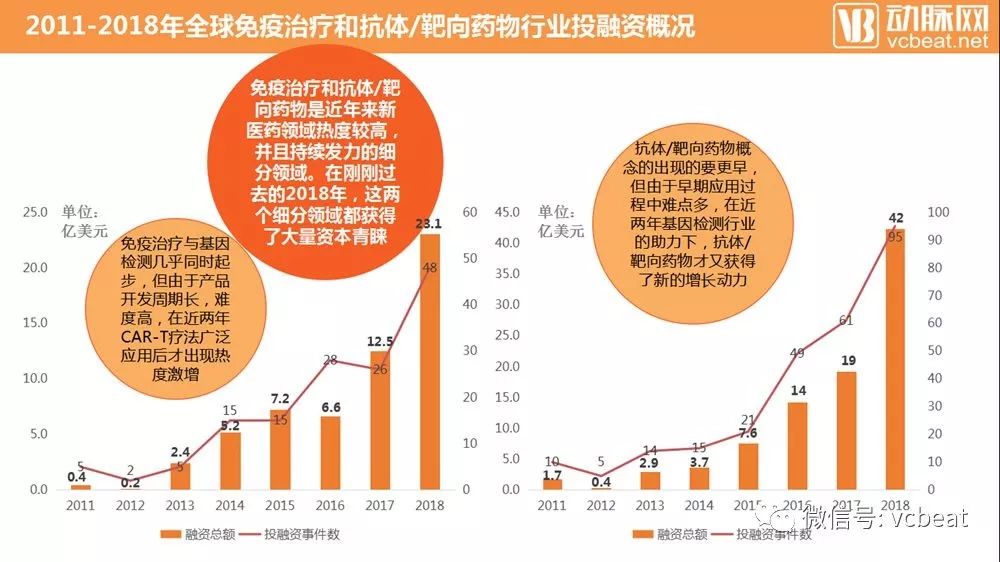
根据动脉网的数据统计,在企业投融资数据方面,免疫治疗和抗体/靶向药物两个领域的企业融资在近几年大幅度上升。二者在过去几年的发展中都走出了标准的指数增长曲线。尤其是在2018年,免疫治疗行业融资总额增长84.8%,抗体/靶向药物则是121.1%。二者都是近几年新医药领域的焦点内容。
在目前的全球十大畅销药中,8种为大分子生物药,这8个大分子生物药中又有6个单抗药。生物药的研发技术难度大,价格昂贵,前期研发和临床试验需要大量资金支持。
国内有将近20家上市公司正在研发生物创新药,国内产品临床申报数量前三甲分别是恒瑞医药、复星医药和海正药业,信达生物和康宁杰瑞的管线数量也超过了10个,这块市场在未来三年里会逐渐爆发。预计每年将会出现4-6个生物创新药,出现1至2个的First-in-Class原创新药。
以PD-1、PD-L1、EGFR等为靶点的靶向药物层出不穷,而CAR-T疗法的逐渐成熟和广泛运用更是直接将免疫治疗推到了舞台中央。即使目前这两个细分领域已经吸引了业内大量的目光,但是这两个细分领域的发展空间仍然非常充足。因此在接下来的几年中,免疫治疗和抗体/靶向药物仍会是新医药领域讨论的重中之重。
在医疗创新时代,动脉网花了近五年的时间,与数千位致力于全球医疗创新的同行们成为了朋友,有数十万的医疗创新从业者通过动脉网了解国内外的发展动态。动脉网很幸运,在合适的时间,和合适的人,做了合适的事情。
而今天,随着中国一系列新药政策的推出、海内外资本的涌入、人才的大批回归,生物领域、创新药研发进入了蓬勃发展的阶段。
在这个产业创新的时候,动脉网亦想通过我们的数据、信息、案例和报告,覆盖这个目前最具活力的领域。
动脉新医药
长按识别上方,解锁更多医药前沿资讯
动脉新医药公众号(biobeat1)希望能够用我们的文字,记录创新药、创新治疗、生物领域的发展,为行业的进步,为各种疾病的治愈做出自己的贡献。
*本文部分资料整理于动脉网2018年未来医疗100强论坛肿瘤创新药产业发展分论坛的嘉宾现场演讲:
贝达药业董事、资深副总裁 万江
《中国创新肿瘤药物的上市之路》
贝达药业资深副总裁兼首席医学官 毛力
《肿瘤新药的中国研究注册策略》
君联资本董事总经理 洪坦
《创新药研发趋势分析》
默沙东肿瘤事业部总经理 牟艳萍
《跨国药企创新药物如何更好服务中国患者》
*封面图片来源:https://www.pexels.com
文 | 刘宗宇
微信 | q19930797
添加时请注明:姓名-公司-职位
后台发送关键词即可获得相关好文
网站、公众号等转载请联系授权
新春特辑
DRG深度解读